Augast 1, 2017
Elizabeth Denton
アミノ酸の側鎖の保護基は、ペプチド研究者にとって、より複雑な分子の合成を可能にするための効果的なツールになります。
多くの場合、側鎖の保護基はFmocベースの合成において、低分子の蛍光物質の添加や、より一般的にはペプチドの環化反応など、ペプチドの合成後の修飾を容易にするために使用されています。
以前の記事では、ivDde保護基の脱保護に関する最適について述べました。今回の記事では、リジンの側鎖からAlloc保護基を脱保護する方法を探ります。
Allocおよび関連するアリルエステル保護基は、ラクタムを経由した環化を利用したペプチドによく使用されています。アリルエステル基とAlloc基を同時に脱保護すると、アミド結合の形成に必要なカルボン酸側鎖と遊離アミン側鎖が露出します。しかし、これらの保護基を脱保護するためには、パラジウム触媒が必要になります。
歴史的には、パラジウム触媒の感度の高さから、これを利用する実験者はこの脱保護を酸素のない厳しい条件下でなおかつ手作業で行うことを余儀なくされてきました。
最近、Wilsonらは、パラジウム触媒を用いて、大気圧条件下でAllocおよびアリルエステル保護基を脱保護する一連の実験を報告しました。この実験では、反応バイアルから大気中の酸素を取り除く努力はしない代わりに、マイクロウェーブ加熱で実施しました。
まず、全自動ペプチド合成装置Biotage Initiator+ Alstraを用いて、標準的なACPペプチド配列を大きなスケールで合成してみました。今回はC末端にallocで保護されたリジン残基が含ました。予想通り、この合成では、高品質の租ペプチドサンプルが得られました(図1)。ペプチドの存在が確認されると、残った樹脂は様々な脱保護条件を評価するために小分けしました。
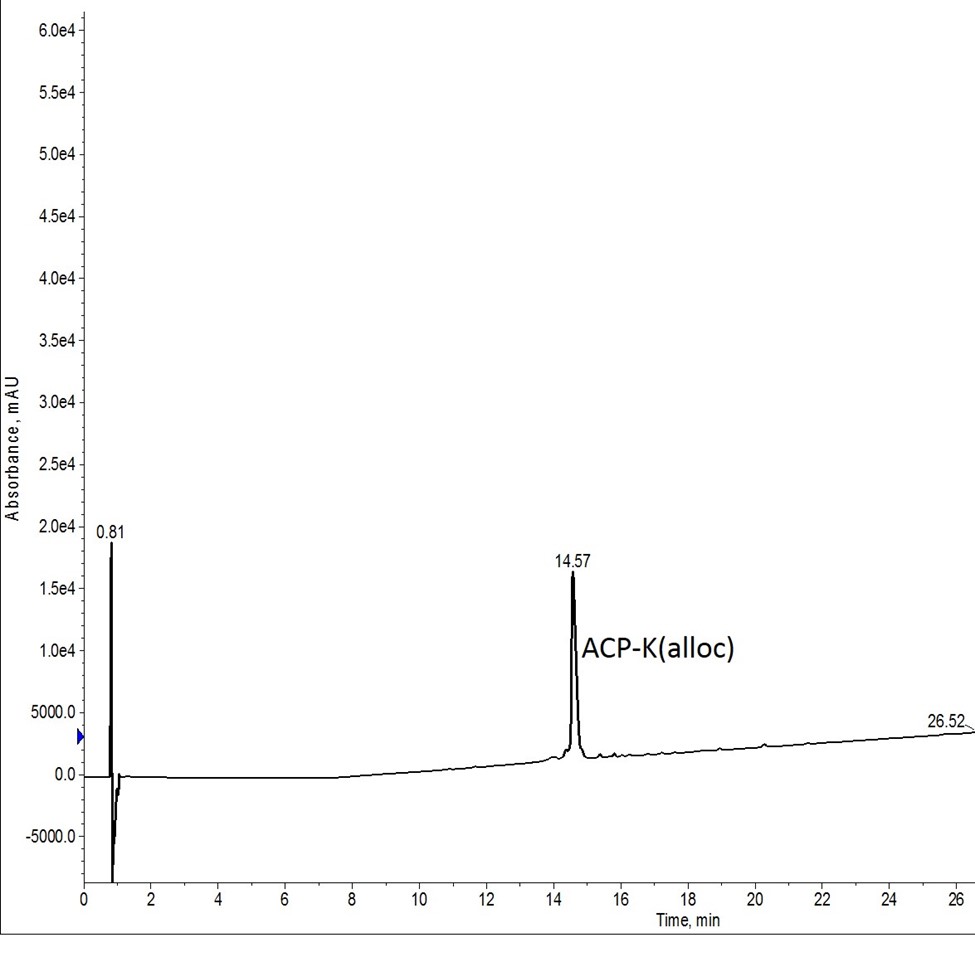
図1: ACP-K(alloc)の粗分析HPLC。Alloc保護基の存在により、ピークの保持時間のシフトが観察されました。
私はまず、Wilsonらによって記述された最適条件をテストしました。私は、1mLのDCM中の15当量のフェニルシランとともに0.25当量のPd(PPh3)を、リアクターバイアルに約30mgの樹脂に手作業で加えました。その後、40℃に加熱しながら5分間反応を進行させました。樹脂を洗浄し、新しく調製した溶液を加え、2回目の反応を繰り返しました。この反応のクロマトグラフィーの結果を示します(図2)。
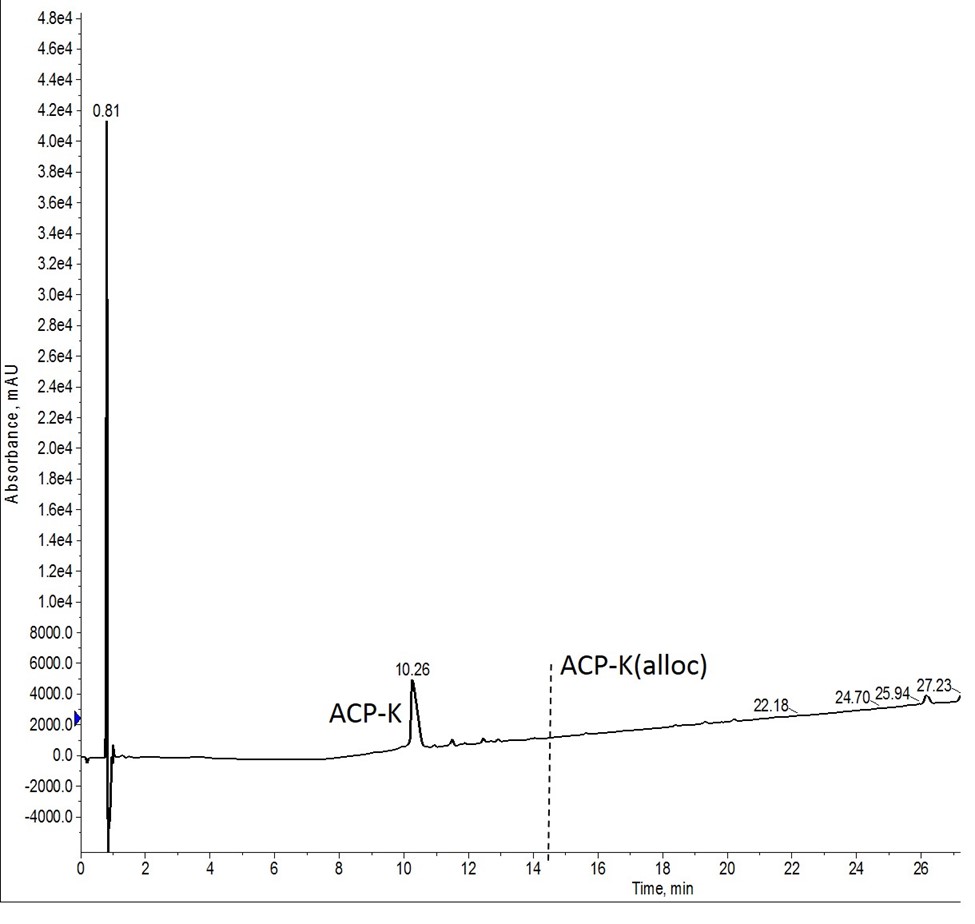
図2: Wilsonらによって報告された条件を用いてAlloc基を脱保護したACP-Kの粗分析HPLC。縦の破線は、残留するAlloc保護基を持つペプチドが溶出する場所を示しています。保護基を含むペプチドは、マススペクトルに確認されませんでした。
正直なところ、この結果には少し驚きました。これ以上手を加えずにここまで結果が出たのは、推奨条件を試してみて初めてです。検出限界の範囲内であれば、Alloc基を含むペプチドは残っていません。
しかし、念のため、同じ手順を3回繰り返し、いくつかの樹脂を脱保護してみましたが、同等の結果になりました(データは示していません)。ここで見落としてはならないのが、Initiator+ Alstraによる正確な温度制御があったからです(図3)。
DCMは非極性溶媒であるため、マイクロウェーブによる加熱は非常に難しく(双極子モーメントがないため加熱しにくい)、さらに沸点が低いため、反応溶媒が蒸発する可能性があります。しかし、リアルタイムの温度モニターとマイクロウェーブの出力制御により、溶媒の蒸発を最小限に抑えながら、目的の温度で素早く反応を進行させることができました。
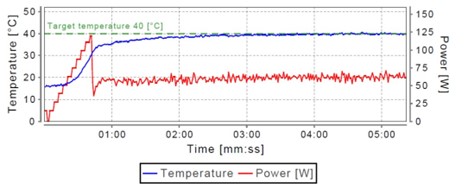
図3: Alloc基の脱保護の際に実施した温度とマイクロウェーブ出力のリアルタイムプロファイル。マイクロウェーブ出力の小さな変動(赤線)により、一定の温度(青線)が維持されていることに注目しています。
発表された反応条件によって、実際に完全に脱保護されたペプチドが得られることを確認した後、私はパラジウム触媒の寿命を調べることにしました。最初の数回の実験では、膨潤した樹脂を入れたリアクターバイアルにすべて手作業で加えていました。しかし、私はこの装置、Initiator+ Alstraのロボットによる分注処理能力を利用したいと思いました。
まず、試薬の添加にリキッドハンドラーを使うことを検討しました。このサンプルでは、Pd(PPh3)とフェニルシランを含む溶液をアミノ酸チューブで新たに調製し(廃棄物を最小限に抑える)、ロボットに反応バイアルに溶液を移分注させました。最初の実験では、脱保護反応のたびに、調製したばかりの溶液を加えました(図4)。開放的な環境と、ロボットによる溶液の移送に要するわずかな時では、すべての試薬を手作業で加えたときのように観察していましたが、この方法で脱保護効率の低下は見られませんでした。
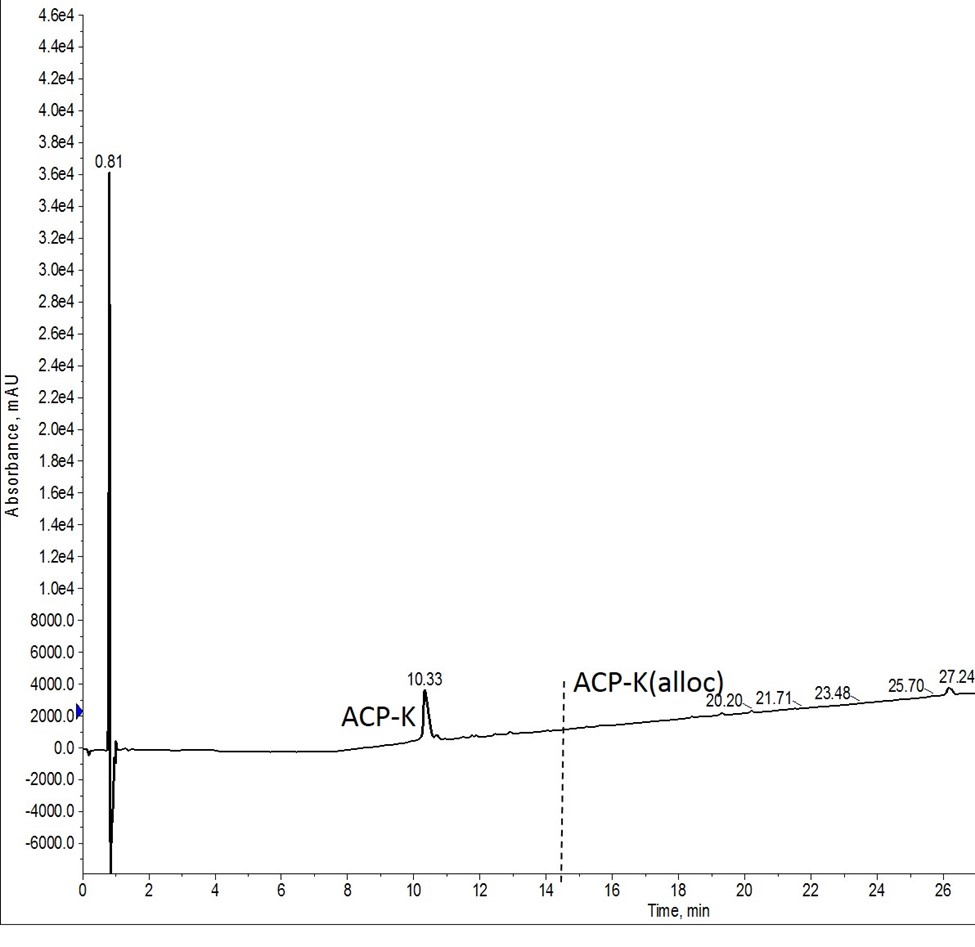
図4: Alloc基の脱保護後の粗 ACP-K 混合物の分析用 HPLC結果。Alloc脱保護試薬は、脱保護反応ごとに新たに調製しましたが、Biotage Initiator+ Alstra の分注処理機能を使用してリアクターバイアルに添加しました。縦の破線は、残存するAlloc保護基を持つペプチドが溶出する場所を示しています。Alloc保護基を含むペプチドはマススペクトルでも確認されなかった。
最後の実験では、Pd(PPh3)とフェニルシランのそれぞれの溶液を調製し、両方の脱保護反応に使用しました(図5)。この場合、2回目の反応の前に触媒溶液が大気にさらされる時間が長くなるため、評価した条件の中で最も脱保護の効果が低くなるのではないかという仮説を想定しました。しかし、この仮説は正しくなく、ペプチドは完全に脱保護されました。
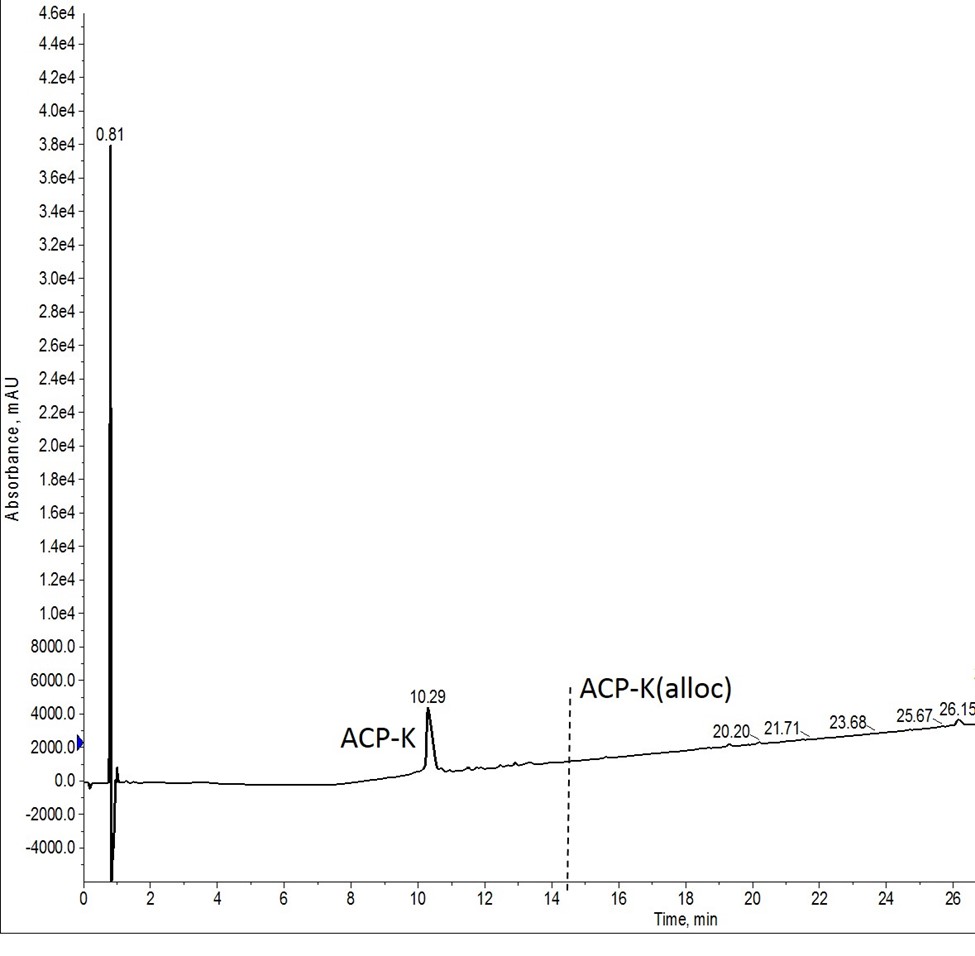
図5: Alloc基の脱保護後の粗 ACP-K混合物の分析用 HPLC結果。Alloc基は、最初の脱保護反応の直前に準備した試薬で除去し、Biotage Initiator+ Alstra のロボット分注処理機能を使用して反応バイアルに添加した。2回目の反応の試薬は、最初の試薬と同時に調製し、使用するまで大気に開放した状態で装置にセットしました。縦破線は、保護基が残存しているペプチドが溶出する場所を示しています。保護基を持つペプチドは、マススペクトルで確認されませんでした。
この発見は、穏やかなマイクロウェーブ加熱による反応促進で、実験者の関与を最小限に抑えながら、完全に脱保護されたペプチドを得られることを実証しており、非常にエキサイティングなことでした。このような条件下で、ペプチドを自動合成装置で合成し、パラジウム触媒溶液をアミノ酸チューブに加えるために一時停止し、自動合成装置をAllocまたはアリルエステルの脱保護のために再開しました。その後、レジン上で全自動ペプチド合成装置による脱保護試薬の分注を直接実施できるかという仮定は、それは可能であると実証されました。
マイクロウェーブによるAlloc基やアリルエステルの脱保護を試されたことはありますか?
ペプチドサンプルの精製にフラッシュクロマトグラフィーの使用を考慮したことがありますか?
側鎖保護基の有用性と Biotage® Initiator+ Alstra™ による複雑なペプチド合成の簡略化についてご覧になりたい方は、リンクからダウンロードしてください。
日本語化:2023年10月
ウェブのみ一部修正:2024年4月
PDFファイルダウンロード(615KB, 2023年10月)