January 10, 2020
Elizabeth Denton
研究室での化学を学ぶ初期からの数年間で教わる合成化合物の分析・同定には、多くの技術が利用できます。NMR 分光法、IR 分光法などのツールは、合成した低分子化合物の確認や構造決定は非常に有用ですが、これらの分析方法はペプチドの迅速な特性評価にはあまり適していません。そのため、ペプチド研究者は、液体クロマトグラフィーのクロマトグラムで観察されるピーク形状や、分子量確認のための質量分析をメインに使用し、合成したペプチドを評価しています。
今回の投稿では、合成後または精製されたペプチドサンプルの分析に使用される質量分析技術について、いくつかご紹介します。
私は決して質量分析(MS)の専門家ではありませんし、それぞれのイオン化法の特徴についても詳しくありませんが、現在使われているいくつかのイオン化法について、より一般的な概要を説明できればと思います。とはいえ、MS とこの分野での進歩は素晴らしいものがあり、さらに期待できるものがあります。
質量分析で検出するためには、まず化合物をイオン化(正または負に帯電)させる必要があります。 最も一般的に使用されているイオン化技術は、以下の通りです。
マトリックス支援レーザー脱離イオン化(MALDI)
エレクトロスプレーイオン化(ESI)
化学イオン化(CI)
o 大気圧化学イオン化(APCI)
電子イオン化(EI)
高速原子衝撃(FAB)
しかし、これらのイオン化法の多くは、ペプチドやタンパク質の分野での応用できるものではありません。APCI、EI、FAB のような方法は、ペプチドを分析するにはあまりに攻撃的で、目的の化合物が断片化されてしまうことがよくあります。ペプチドやたんぱく質が切断されたフラグメントの配列が予測可能であれば利点になりますが、単純な確認・同定のためには、生成されるスペクトルは非常に複雑になってしまいます。
そのため、現在ではペプチドの分析においては ESI と MALDI がイオン化法として質量分析分野の主流となっています。これらのイオン化法は非常に穏やかであるため、ペプチド(あるいはその多価イオン状態)、タンパク質、さらに最近では タンパク質複合体のイオン化、検出、あるいは配列決定が可能となっています。これらの方法はどのように機能し、なぜペプチドやタンパク質に適しているのか説明していきます。
MALDI-MS は、試料を適切なマトリックス溶液に希釈し、プレート上にスポットして乾燥させた後、レーザー光で気相にイオン化します(図1)。
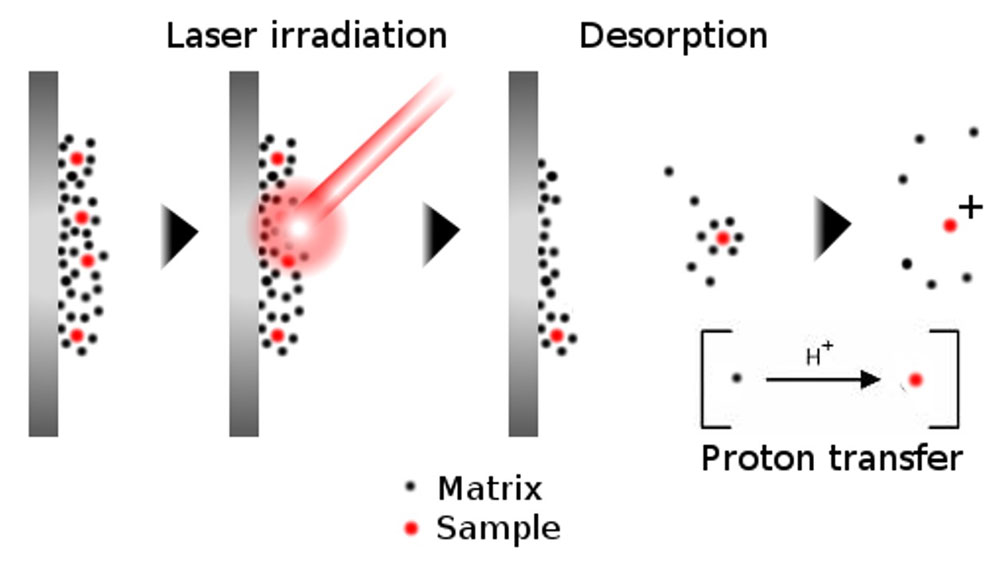
図 1: MALDI-MS よるイオン化の原理。不揮発性の試料をマトリックス溶液に希釈し、プレート上で乾燥させます。サンプルをレーザーで叩くと、マトリックスとサンプルの固体が蒸発し、プロトンの移動が起こり、サンプルがイオン化されて検出されます。
マトリックスには 様々な種類 があり、いくつかの主要な役割については以下の通りです。
マトリックスは、通常揮発しない化合物(ペプチドやタンパク質など)の揮発を促進します。
マトリックス化合物は、レーザーエネルギーの一部を吸収し、目的の化合物の切断やフラグメント化を制限する代替物として機能します。
マトリックスは、気化した目的の化合物をイオン化するイオンの化学的供給源として機能します。
マトリックス自体がイオン化に寄与するため、この手法で検出される化合物はほとんどの場合、単一の電荷しか持たないので、目的の化合物を迅速に同定することができます。重要なのは、試料は分析前に MALDI プレートにスポットされるため、MALDI-MS は擬似的なハイスループットと考えることができる点です。私が過去に使用した MALDI プレートには 96 のスポットがあり、各スポットの分析にはわずか 1 分ほどしかかかりませんでした。MALDI を最もよく使ったのは、ペプチドを複数合成したときのピークを特定するためで、特に初めて合成するペプチドを同定するときに使いました。
エレクトロスプレーイオン化(ESI)では、化合物を溶かした溶液のままソースに導入し、溶液をキャピラリーから噴霧し、加熱されたガス流とともにコーンに向け、電流でアシストし、質量検出器に導入されます(図 2)。ESI は、試料をイオン源に導入するための送液する溶媒を必要としないため、液体クロマトグラフィーシステムと多様な質量検出器を直接接続するのに適しています(後述します)。
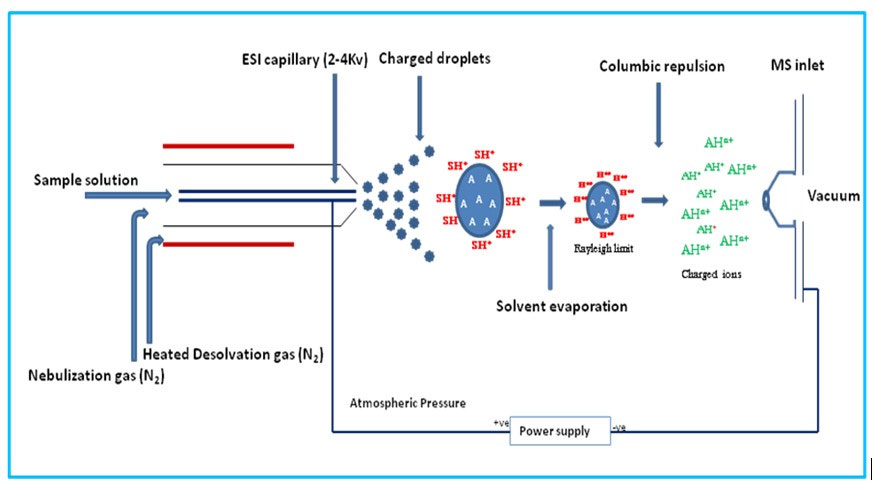
図 2: エレクトロスプレーイオン源(ESI)によるイオン生成の原理。試料イオンは送液する溶媒との溶液中で生成され、キャピラリーを通してイオン源に噴霧され、加熱されたキャリアーガスと電流によって検出コーンに導かれます。イオン源内を移動する間に、キャリア溶媒は蒸発し、検出器に導入される試料イオンのみが残されます。
このとき、試料を含む液滴は蒸発し、イオン化された化合物が残って質量検出器に導入されます。この過程で、化合物は複数のプロトンを持つようになり、複数の正電荷を持つ荷電化合物(ペプチドでは+2、+3、+4 以上が一般的です)を生成することがあります。これは分析の難易度を上げるように思えますが、質量分析ソフトウェアの進歩により、目的のペプチドの多価イオンを親質量まで再結合できるデコンボリューション・パッケージが利用できるようになりました。しかし、重要なことは、多価イオンは検出される質量/電荷をほとんどの質量分析計の検出範囲内(多くの場合 2000-3000 Da)にまで下げるということです。質量分析では、検出される質量は真の質量ではなく、電荷あたりの質量の比(m/z)であることに留意する必要があります。
さて、化合物のイオンを作り、その存在を検知します。これは何を見て、どうすればわかるのでしょうか? MALDI-MS でのイオン化の場合、その答えは明らかです。検出された質量は、多くの場合、一価の質量イオンになり、その化合物を同定できます。余分な作業は必要ありません。
ESI 法の場合は、もう少し考える必要があります。感度の低い装置では、ガウス型関数のような山なりのピーク形状を持つ主要な質量のみが表示されることが多いでしょう。この場合、先ほど紹介したデコンボリューションソフトウェアを使えば、簡便に同定することができます。幸いなことに、自分自身がこのペプチドを合成したのですから、最終的な化合物の予想分子量はわかっているはずです。多価イオンの質量を求めるには、次の式を使います。
(MW + x)/x
ここで、x はペプチド全体の電荷状態に寄与して付加されたプロトンの数になります。例えば、+3 電荷状態のペプチドの質量は、ペプチドの分子量に 3Da を加え、この数字を 3 で割れば計算することができます。
高分解能の質量検出器を使うことができれば、優勢な質量だけでなく、異なる原子の同位体存在比(C13 , N15 , etc)に比例した各質量を分解できることもあります(図 3)。これらの各ピーク間の質量差を詳しく調べると、その特定のピークがどの電荷状態に相関しているかがわかります。
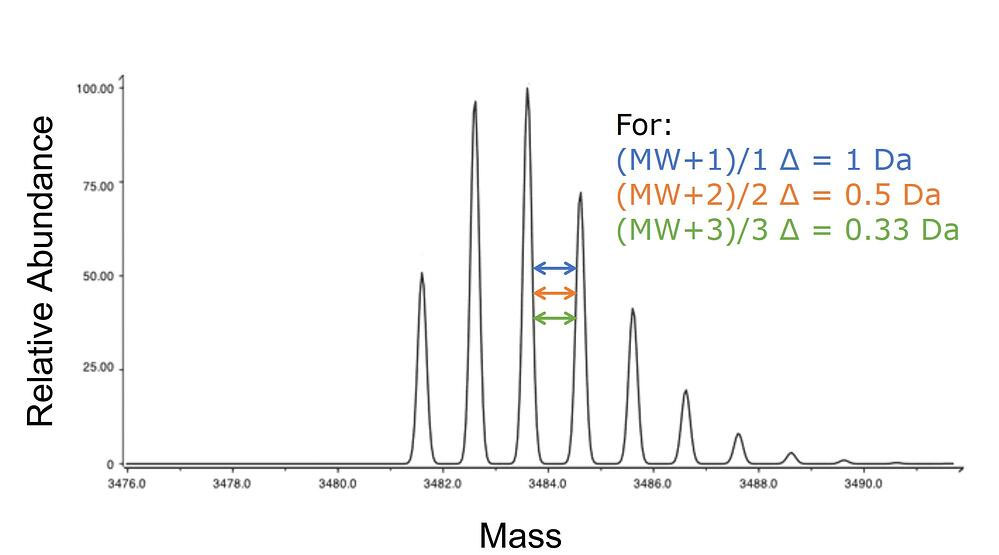
図 3: ESI-MS でイオン化され、高感度質量分析計で検出された同位体質量のピーク。ピーク間の質量の差は、目的の特定の質量で測定された電荷状態を示しています。
質量分析装置は、ペプチド研究者が合成ペプチドを特性評価する上で非常に重要なツールとなったため、その大きく高価な箱の中で何が起こっているのか、完全に理解することが重要です。この投稿では、現在ペプチド領域で最も一般的に使用されている確認・同定方法の重要な違いを明らかにすることができたと思います。
質量分析で遭遇したエラーについて教えてください。
Biotage ツールによるペプチド合成とワークフロー全体の効率化の詳細については、リンク を参照してください