July 20, 2020
Elizabeth Denton
海外の大手製薬会社は、次の大型ペプチド医薬品の開発を目指し、ペプチド探索プロジェクトに力を入れ始めています。このような取り組みでは、数百から数千のペプチドが合成されることが多く、パラレル合成でのプラットフォームで、室温でのペプチド合成プロトコルが必要とされています。
前回、マイクロウェーブ合成 での収量を確保するために必要な最低限のアミノ酸当量数を明らかにしました。室温で合成を行う場合、マイクロウェーブ加熱とは異なる条件が必要となることは明らか出す。当量数が合成結果にどのような影響を与えるかを探ってみましょう。
さて、私は室温合成に関しては、あまり経験がないことを自身で認めています。これまで合成したペプチドは、ほとんどすべてマイクロウェーブ加熱で実施していました。しかし、化学反応自体は同じなため、正確な条件を記した論文もいくつか読んだので、実施しました。
この実験のために、JR 配列と呼ばれる、難しいが短いペプチド(配列:WFTTLISTIM)を合成することにしました。マイクロウェーブ加熱でも des-Trp であるトリプトファンが欠損した配列は観察されることがあります。
最初の合成では、アミノ酸とカップリング試薬を 3 当量条件で実施することにしました。これは、合理的なマイクロウェーブ加熱合成に必要な最も少ない当量になります。Biotage® Initiator+Alstra™ で、 0.5 M アミノ酸溶液、 0.5 M DIC、 0.5 M OxymaPure を 40 分間のシングルカップリングで使うようにプログラムして、合成を開始しました(図 1)。
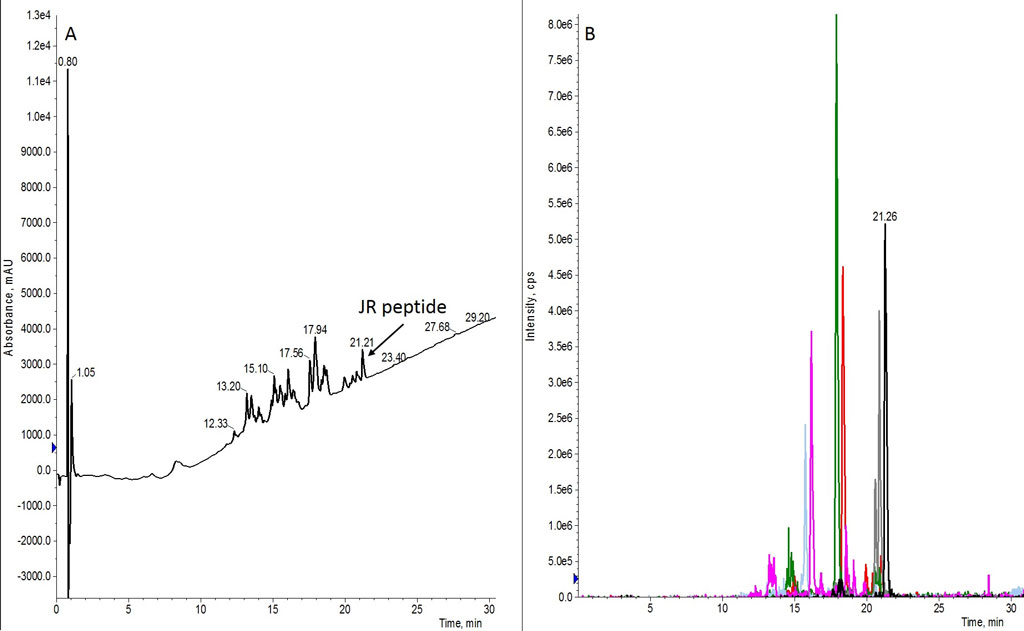
図 1: 3 当量のアミノ酸を用いて合成した JR 10-mer 配列の分析 HPLC(A)と抽出イオンクロマトグラム(B)。
予想通り、この合成はかなり夾雑物が含まれていました。目的のペプチドも存在しますが、欠損ペプチドや伸長しきっていない生成物が粗ペプチドの大部分を占めていました(ピークの割り当てについては表 1 を参照)。UV の吸光度から、粗ペプチドのサンプル溶液に最も多く含まれていた生成物は des-Trp 配列であることが示唆されました。トータルイオンクロマトグラムから、同定された欠損配列のそれぞれの親質量を抽出すると、ピークの割り当てに役立ちました(図 1B)。
| ペプチド配列 | 分子量 | 保持時間(分) | XIC クロマトグラムの色 |
|---|---|---|---|
| WFTTLISTIM | 1212.47 | 21.21 | 黒 |
| WFTLISTIM | 1111.36 | 20.78 | 灰色 |
| FTTLISTIM | 1026.26 | 17.94 | 赤 |
| FTLISTIM | 925.15 | 17.56 | 碧い |
| TTLISTIM | 879.1 | 16.12 | マゼンタ |
| TLISTIM | 777.9 | 15.70 | ライトブルー |
表 1.室温で合成した JR ペプチドの粗分析 HPLC-MS で観測されたペプチド配列。
2 回目の合成では、5 当量のアミノ酸で合成を行いました。私は、特に低価格のアミノ酸を使用する場合、最高収率の粗ペプチド生成物を確保するために、マイクロウェーブ加熱合成においても通常 5 当量を使用します。より公平に比較するために、アミノ酸濃度、合成スケール、カップリング反応時間を前回の合成と同じにして実施しました(図 2)。
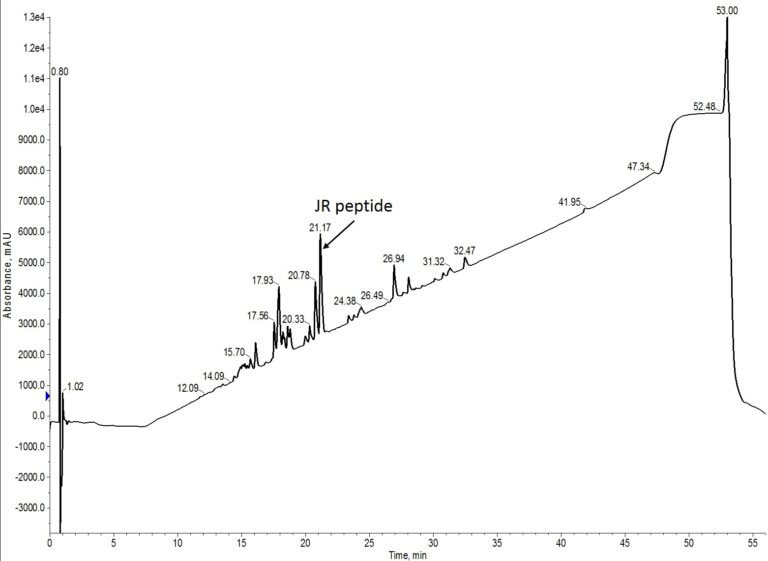
図 2: 5 当量のアミノ酸を用いて合成した JR 10-mer ペプチドの粗分析用 HPLC。
まず 2 回目の合成においても、1 回目の合成と比較して、全体的なクロマトグラフィーのパターンは非常によく似ていました。より多くのアミノ酸当量を使用することで合成結果は改善され、途中で欠損していないペプチドが粗生成物の大半の構成要素となりました。しかし、des-Trp と des-Thr の欠損ペプチドは、まだ粗生成物全体のかなりの割合を占めていました。改善の余地があることは間違いありません。
最終的な合成では、アミノ酸当量を 2 倍の 10 当量に増やしました。特定のペプチド合成のプロトコルを調べていると、この条件を見つけることがよくあります。前の 2 つの合成と同様、0.5M のアミノ酸溶液に 0.5M のカップリング試薬を使い、40 分間シングルカップリングで実施しました(図3)。
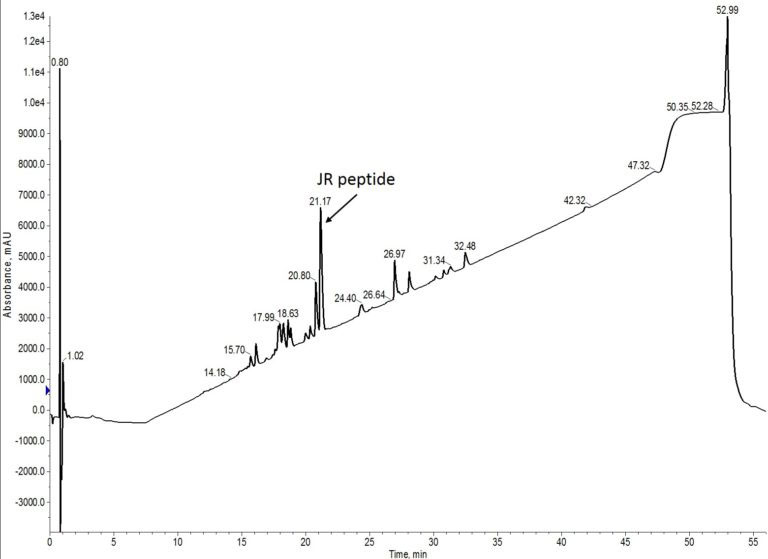
図 3: 10 当量のアミノ酸を用いて合成した JR 10-mer ペプチドの粗分析用 HPLC。
この条件では、これまでで最も良い結果が得られています。他の欠損ペプチドが大幅に減少し、目的のペプチドの割合が増加しました。最も多い不純物は、des-Thr 配列でした。しかし、これはあまり驚くべきことではありません。アミノ酸をレジン上の反応点へ結合させることは、側鎖の小さなアミノ酸であっても、本質的に難しいことです。
いずれのプロトコルもシングルピークの純度の高いペプチドは得られませんでしたが、アミノ酸当量が増えるごとに、当量の少ない合成よりも純度の高い粗生成物が得られました。この合成をさらに改善するために次の戦略を考えています。
この合成に対する好奇心が刺激されたので、近いうちにこのペプチドをもっと研究してみようと思っています。どのような条件でシングルピークの純度が得られるか、またお知らせしたいと思います。
難しいペプチド合成を室温で行う場合、どのような条件で行うのでしょうか。
Biotage のツールで難しいペプチドの合成を可能にする方法については、リンク を参照してください。