July 13, 2020
Elizabeth Denton
私たちは時々、新しいグループがペプチド合成を研究に取り入れる際にはそのサポートをしています。新しい事業や研究を立ち上げたばかりのため、そのグループ内にペプチド合成の経験者がいない場合が多いです。その結果、このようなグループから受ける最も一般的な質問の一つに、合成の際にどれくらいのアミノ酸を使うべきかというものがあります。
今回の記事では、アミノ酸の当量数について解説していきます。アミノ酸の当量が多ければ、カップリング反応をほぼ完了できることが多いですが、今回の課題としては、どれだけ少ない当量でペプチドをうまく合成できるかという点に焦点を当てていきます。
アミノ酸の当量については、ペプチド合成のコストを考え始めると、重要な問題になってきます。多くのアミノ酸の価格はここ数年で大幅に下がっていますが、非常に高価なアミノ酸もあります(同位体標識アミノ酸は価格を考えてほしい)。合成ペプチドの総コストを最小限に抑えるためには、一度の合成で確実にペプチドを合成することが重要になります。以前の記事で、特に長いペプチドの合成には アミノ酸の濃度 が重要であることを述べましたが、その液量に何当量のアミノ酸が含まれていればよいのかという疑問が出てきます。
この疑問を解決するために、私は 18 アミノ酸の両親媒性ペプチドでらせん構造をもつ Helix A を合成することにしました。このペプチドは適度な配列の長さがありながら、疎水性アミノ酸と親水性アミノ酸が均等に分散しているため、比較的簡単に合成できます。アミノ酸の当量を変えながら、スケール、カップリング試薬、反応温度と時間を一定にして、ペプチドを3回合成しました。
私の目標は、大幅な反応の最適化をせずにペプチドをうまく合成できる最小限のアミノ酸当量を特定することでした。確かに極端に少ない当量で反応を実施することもできますが、合成を成功させるには、かなり広範囲なカップリング反応の最適化が必要になるためです。
そこで、手始めに、まずペプチド合成の研究者がやりたがらないことをやってみました。1 当量のアミノ酸を使って Helix A を合成しました。全自動ペプチド合成装置 Initiator+ Alstra™を使用して、カップリング試薬として DIC と Oxyma を用いて、各アミノ酸を 75℃ で 5 分間反応させました。多くの人が予想したように、この合成は完全に失敗しました(図 1)。
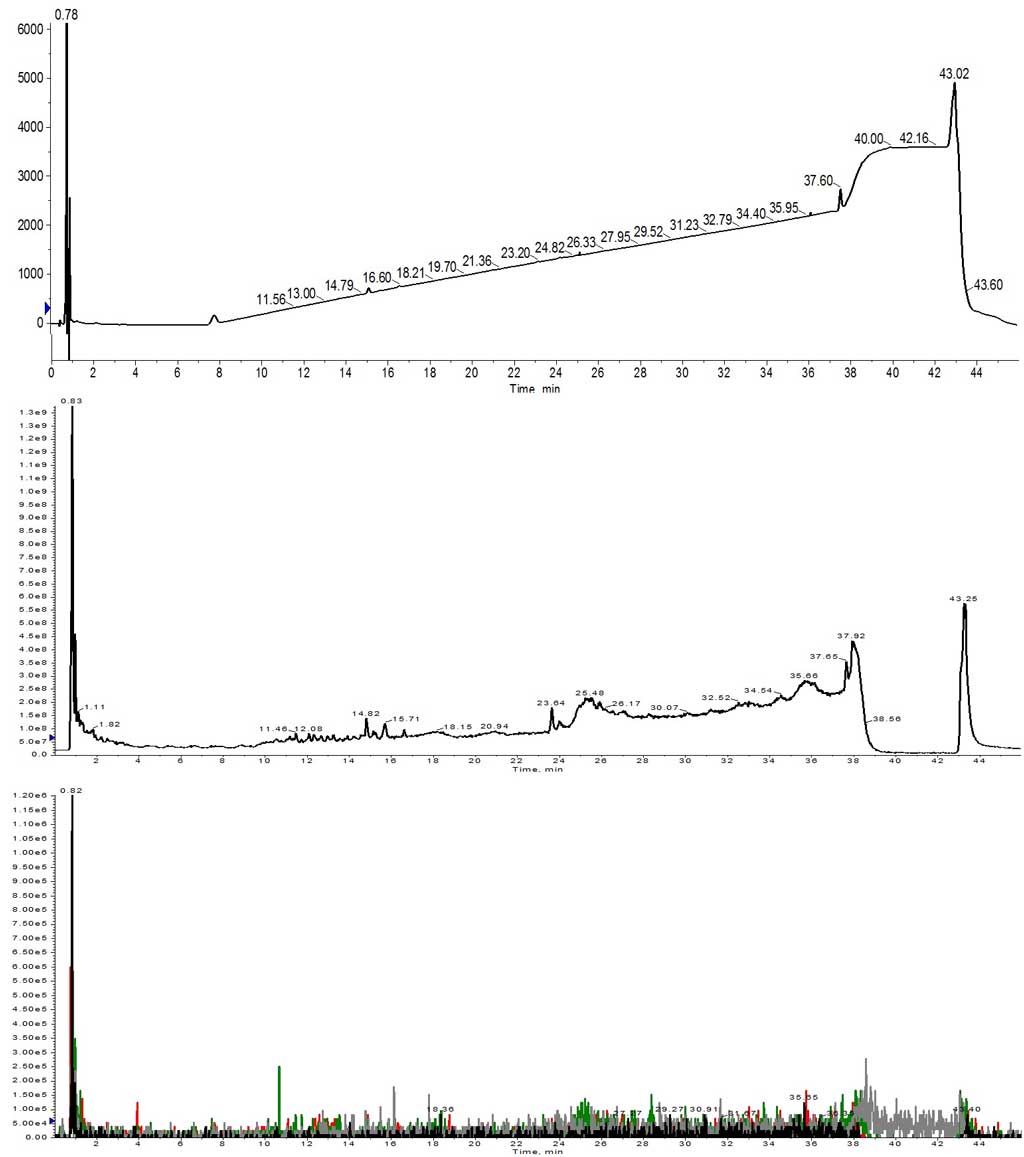
図 1: 1 当量のアミノ酸を用いて合成した Helix A の HPLC-MS分析結果。UV スペクトル(上)、TIC(中)、TIC 内の特定イオンの検索(下)、目的のペプチドは同定できませんでした。抽出されたイオンは、1113 (m+2, 黒)、742 (m+3, 赤)、557 (m+4, 緑)、445 (m+5, 灰)でした。
UV にはピークがなく、マス TIC でもごくわずかピークしか観測されませんでした。TIC イオンの抽出を試みても、目的のペプチドの電荷状態が特定できませんでした。このような結果になったのは、いくつか原因がありそうです。まず第一に、樹脂の反応点に対してアミノ酸が同じモル量しか使用されていないということです。アミノ酸と樹脂との反応では、樹脂側は動かないためアミノ酸を多く使用して反応点としっかり反応させる必要があります。このため、合成を成功させるには、1 つ 1つのアミノ酸分子がカップリング試薬によってうまく活性化され、カップリング反応に消費されることです。ただし、1当量ではこのようなことが実際に起こる確率は低いと言わざるを得ません。次に考えるべきは濃度になります。
アミノ酸溶液と DIC 溶液は、効率的で均一なマイクロウェーブ加熱の推奨する最小液量にするため、反応容器内の濃度は半分の 0.1M に希釈していました。アミノ酸が溶液中でカップリング試薬と生産的に相互作用し、サンプルを希釈すると、次に活性化されたアミノ酸が伸長するペプチド鎖のアミノ末端と相互作用する確率がさらに減少します。この結果は、樹脂のローディング量に対しする超化学量論的な当量のアミノ酸を使用する理由を浮き彫りにしています。
2 回目の合成では、アミノ酸を 2 当量に増やし、アミノ酸と DIC の濃度を通常の 0.2M にしました。この合成では、目的のペプチド生成物ではないものの、ペプチド生成物を得ることができました(図 2)。
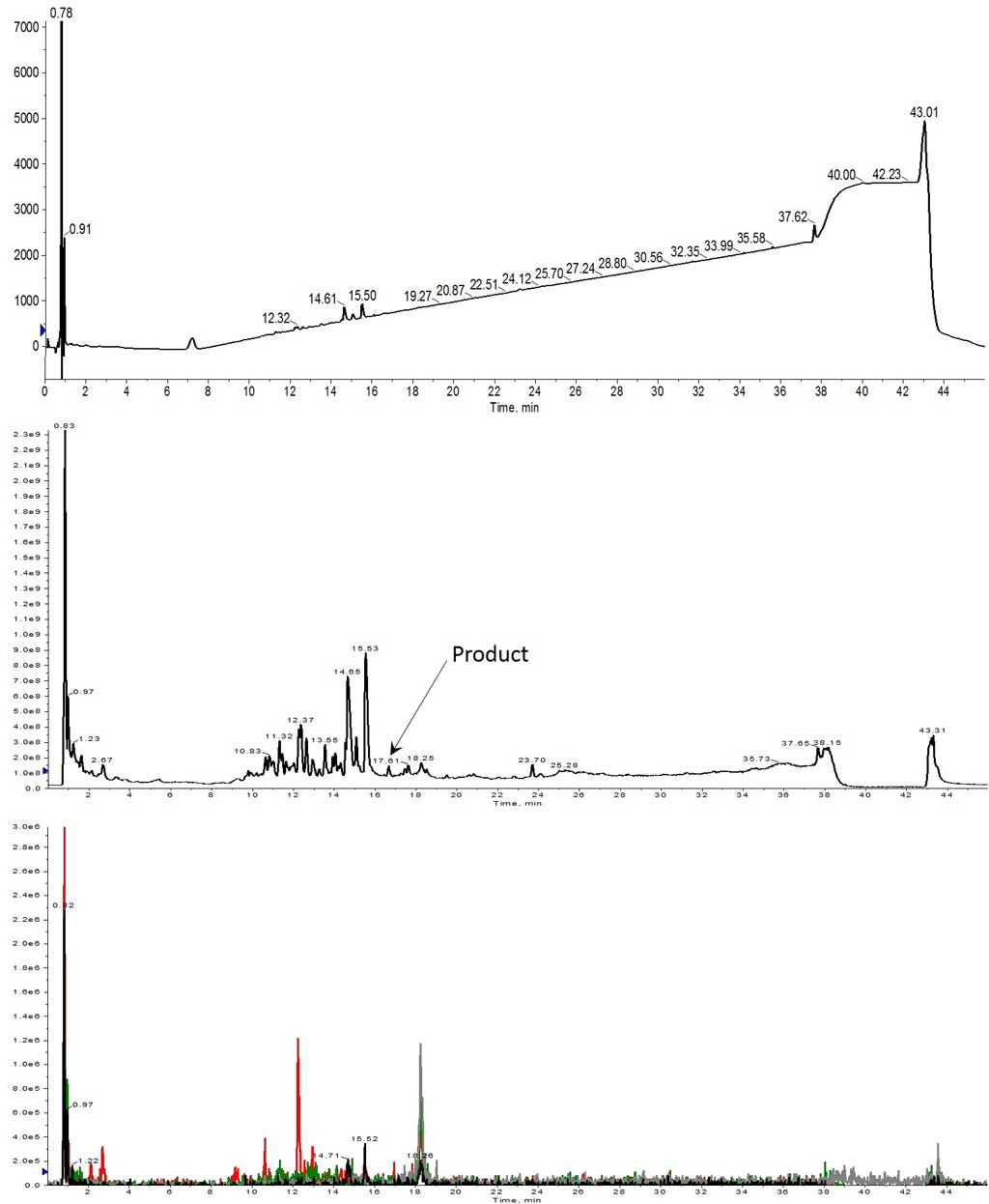
図 2: 2 当量のアミノ酸を用いて合成した Helix A の HPLC-MS分析結果。UV スペクトルでは、ペプチド生成物は観察されませんでした(上)。TIC(中央)ではごく微量であり、抽出 TIC(下)で確認できました。抽出されたイオンは、1113 (m+2, 黒)、742 (m+3, 赤)、557 (m+4, 緑)、445(m+5, 灰) でした。
当量を増やすと、期待通り、わずかながら改善しました。残念ながら、目的のペプチドは溶液中にはほとんど確認されませんでした(図 2 下)。しかし、7、9、13 アミノ酸のペプチドに対応するいくつかの MS スペクトルを確認することができたので(それぞれ保持時間 14.65 分と 15.53 分)、次の検討で目的の全長ペプチドが得られるかもしれないという希望が湧いてきました。
3 回目の合成では、アミノ酸を 3 当量に増やし、濃度は前回の合成と同じ 0.2M のままとしました。最終的に、目的のペプチドを MS スペクトルで確認することができました。さらに満足なことに、目的のペプチドは UV スペクトルにおいてメインの生成物と得られました(図 3)。
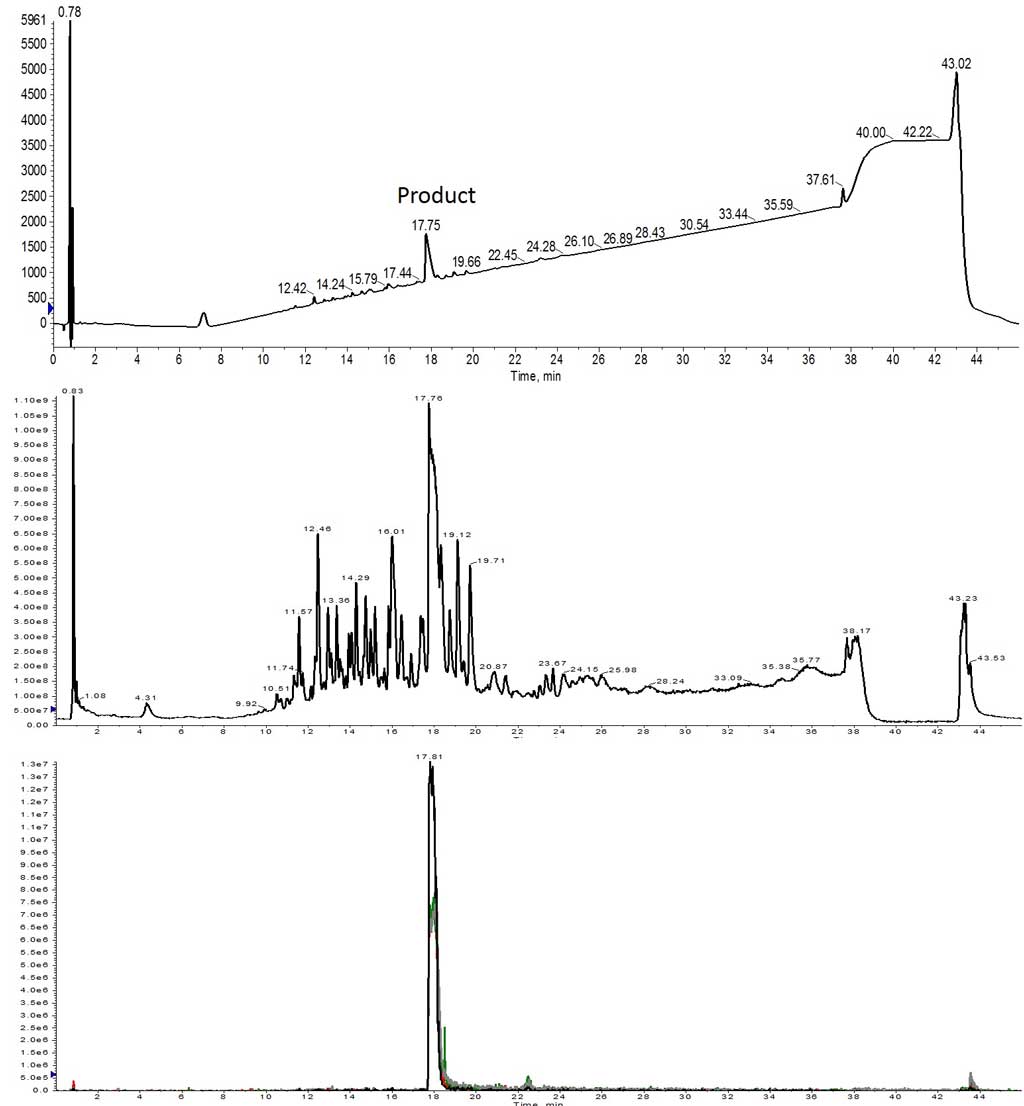
図 3: 3 当量のアミノ酸を用いて合成された Helix A HPLC-MS 分析結果。目的の生成物は、UV スペクトルのメインピークとして存在し(上)、TIC スペクトルでも最も豊富なイオンとして存在しています(中央)。TIC から抽出すると、4 つの電荷状態すべてで多く存在し、重なり合っています(下)。 抽出されたイオンは、1113 (m+2, 黒)、742 (m+3, 赤)、557 (m+4, 緑)、445 (m+5, 灰) でした。
UV スペクトルから、このペプチドの精製は比較的簡単であることが示唆されました。高収率で比較的純度の良い粗ペプチドを確保するには、カップリング反応の大幅な最適化は必要とせず、3 当量のアミノ酸が必要であるという考えをさらに裏付けてくれました。
当量を増やせば、確実に全体の収量は向上し、目的ペプチドの純度も上がる可能性があります。逆に、上記で示したように当量を減らせば、合成結果は十分に得られない可能性もありますが、目的ペプチドを得た上でコストを削減することができます。これは、ある程度平均的な長さのペプチドであり、これらの結論は、長鎖ペプチドや合成難度が高いペプチドには当てはまらない可能性が高いことを覚えておいてください。
マイクロウェーブ加熱によるペプチド合成では、アミノ酸を何当量を使用するのが良いのでしょうか。
複雑なペプチドの合成に Biotage のツールがどのように使われるかについては、「Synthesizing Disulfide-rich Peptides」の Elizabeth のウェビナー、リンク を参照してください。