December 3, 2020
Elizabeth Denton
ペプチドの精製をもっと早く(そして安く)できないかと考えたことはありませんか?私たちペプチド研究者は、高純度のペプチドを得るために、ほとんど逆相HPLCに依存しています。
しかし、このプロセスは非常に時間がかかり、成功させるためには高価なカラムと溶媒を必要とすることがほとんどです。そこで逆相フラッシュカラムクロマトグラフィーを用いてペプチド精製を行えば、わずかな時間とコストで精製を完了させることができます。
ここでは、逆相フラッシュカラムクロマトグラフィーによるペプチド精製におけるグラジエントの最適化について紹介し、標準的なHPLC精製の方法論との類似点を強調したいと思います。
私は、全自動LC/MSでペプチドを精製した経験がありますが、一方で、手動でサンプルを注入し、手動でフラクションを回収するという昔ながらの大変な手間がかかる方法でペプチドを精製した経験もあります。今回、Biotageでキャリアをスタートさせ、フラッシュカラムクロマトグラフィーに触れたことで、標準的なHPLCにおけるグラジエント最適化のルールがフラッシュカラムクロマトグラフィーにも適用できるかどうか試してみることにしました。
そこで,全自動ペプチド合成装置Biotage® Initiator+ Alstra™ で28アミノ酸のペプチドを200 µmolスケールで合成し,約400mgの粗生成物を得られました。LC/MSの分析結果では、ペプチドは25%-30%のアセトニトリルで溶出し、目的のペプチドを確認しました。
この時点で、私は以前オートサンプラー付きのHPLCをセットアップし、粗ペプチドを何度も(しばしば何度も)注入するプロセスを実施していました。しかし、今回は逆相フラッシュクロマトグラフィーシステムに切り替えてペプチドを精製しました。
私はまず、最小限の量でカラムに最大限ロードできるように、ペプチドをDMSOに溶かしました。 精製中のCysやMet残基の酸化が心配な場合は、DMFを代替の高濃度での注入溶媒として試してみてください。
私は、最適な移動相グラジエントを特定しながら、12gのBiotage® Sfär C18カートリッジに50mgの粗サンプルをロードすることにしました。50 mgの負荷量はカートリッジのC18の0.4%に相当し、一般的なRP-HPLCカラムと比較して4倍の負荷量となります。
最初の注入では、標準的な条件の逆相グラジエントを少し変更して、流速を12 mL/minから50 mL/minに増やしました(図1)。流速を上げることで、ポンプの作用によるピークの分解を最小限に抑えつつ、カートリッジの圧力制限の範囲内に収めることができます。グラジエントは、10%のアセトニトリルから100%のアセトニトリルまで、10カラムボリューム(6.36%/分)で設定しましたが、その理由は2つあります。
1つは、分析用HPLCカラムを使用した場合と同様のペプチド溶出条件を確保するためです。すべてのC18カラムが同じように作られているわけではなく、粒子径、ポアサイズ、シリカが分子保持に劇的な影響を与えることがよく知られています。
2つ目の理由は、グラジエントを評価するためのフレームワークを確立したかったからです。グラジエントの長さが変わると分離効率の比較が難しくなるため、グラジエントの条件を一定にしました。
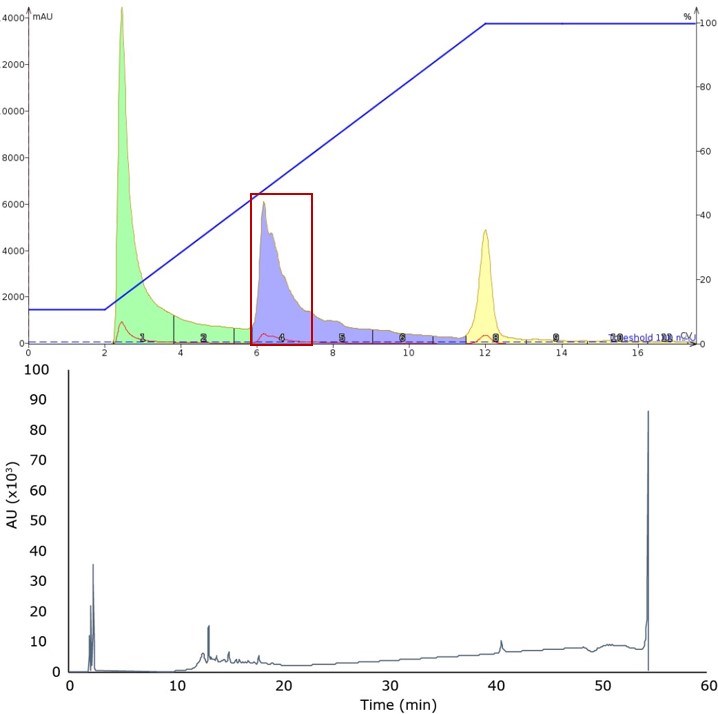
図1: 10%から100%のアセトニトリルの初期グラジエントで観察されたペプチド溶出結果(上)および分取したフラクションの分析用HPLCクロマトグラム(下)。目的の生成物は、質量分析によりメインピーク(保持時間約12分)で同定されました。
ピーク形状は比較的シャープですが、後方の肩の部分は、サンプル中に欠損ペプチドなどが存在することを示唆しています。混合しているペプチド配列をさらに分離するために、グラジエントの勾配を下げ、20%から60%のアセトニトリルまで10 CV (2.82%/分) で実施しました (図 2)。
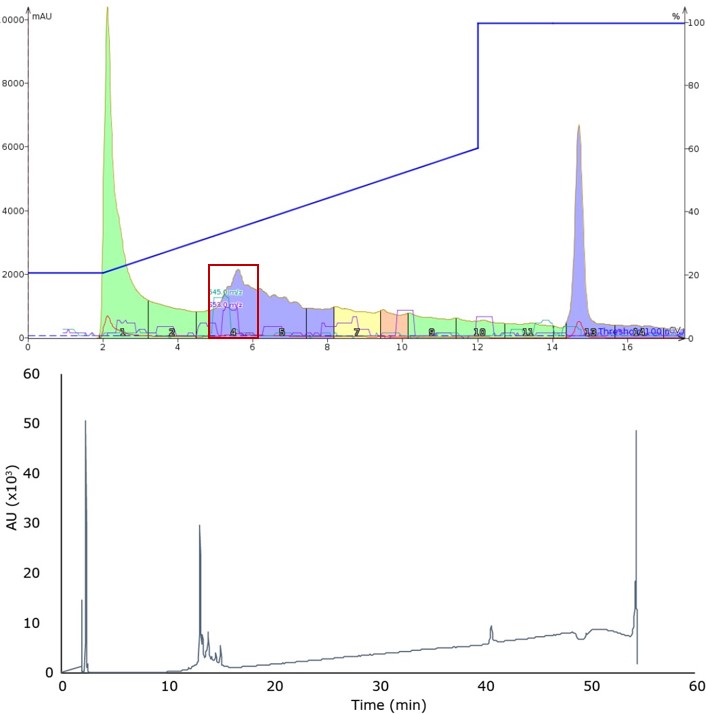
図2: 20%から60%のアセトニトリルを含むグラジエントで観察されたペプチド溶出結果(上)およびメインピークである分取したフラクションの分析用HPLCの結果(下)。
元のピーク形状は明らかに悪化していますが、注入1と注入2で分離されたメインピークフラクションの分析HPLC/MSの比較(図2)から、分離と全体のフラクションでの純度が改善されたことがわかります。このことから、フラッシュカラムクロマトグラフィーにおいても、通常のRP-HPLCと同様に、浅いグラジエントと高い流速を使用することで、ペプチドサンプルの純度を向上できることが示唆されました。
3回目の注入では、グラジエントの傾きをさらに小さくし、移動相の濃度変化をHPLCで使用するのと同様の速度に抑えました。このグラジエントは、20%から30%のアセトニトリルまで10CV(0.706%/分)で行われ、これまでのグループの中で最もひどいクロマトグラフィーとなりましたが、目的のペプチド生成物を含む最もきれいなフラクションも得られました(図3)。
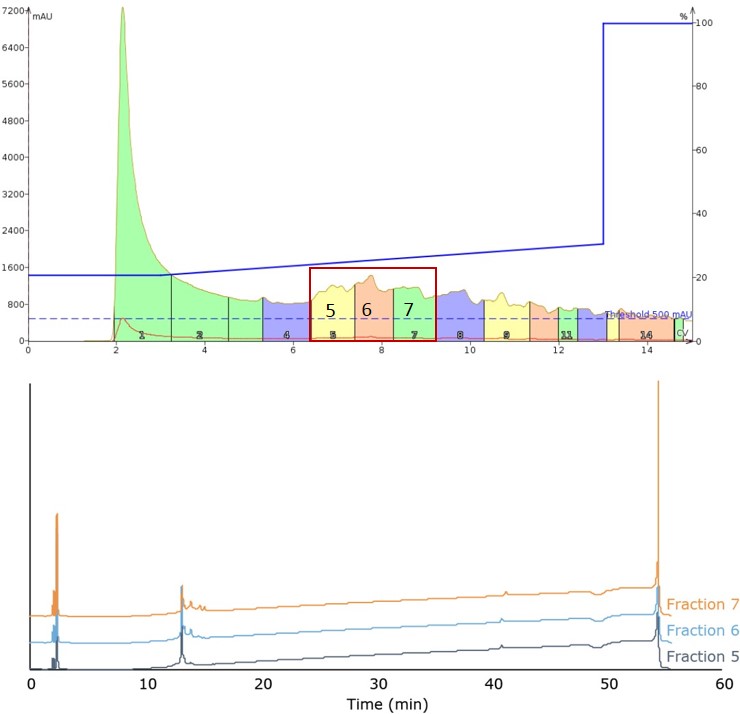
図3: 20%から30%のアセトニトリルを含む移動相グラジエントによるペプチドの溶出結果(上)。ピーク幅が広いため、フラクション5、フラクション6、フラクション7(下)の分析用HPLC分析が必要である。メインピークには、すべてのフラクションで目的の生成物が含まれている。
この最適化されたグラジエントを手にして、私は残りの 200 mg のペプチドをできるだけ迅速に精製しようとしました。フラッシュクロマトグラフィーでのリニアグラジエントに通常適用されるルールに従って、60gのSNAP Ultra C18カートリッジを選択し、分取時間を維持するために流速を上げ、800μLのDMSO中で200mgすべてをカートリッジに注入しました(図4)。粗ペプチドは、注入量を大幅に増やしても、クロマトグラフィーの挙動が維持できていることが注目に値します。これは、少ないロード量で最適化されたグラジエントが今回のロード量での精製に容易に移行できることを示しています。
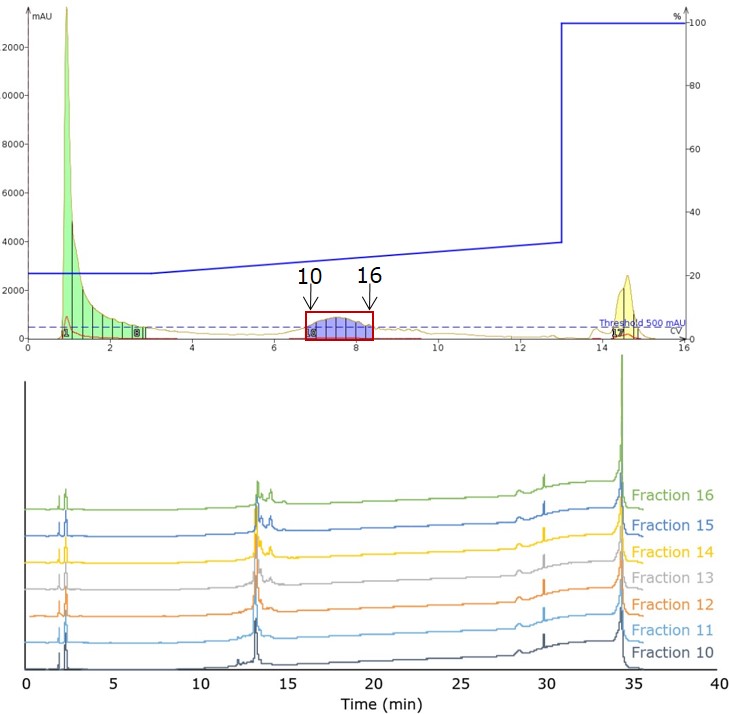
図4: 大きなロード量(200 mg)および最適化された移動相グラジエントを用いた精製時に観察されたペプチドの溶出結果(上)。メインピークに含まれる各フラクションの分析用HPLC結果(下)。
分取した各フラクションを分析用HPLCで確認すると、フラッシュカラムクロマトグラフィーによるペプチド精製で迅速に実施でき、目的に合わせた純度の高いペプチドが得られました。最初の数フラクションはすぐに使用できる可能性がありますが、後のフラクションは、初期の結果から予想されるように、適切な純度レベルに達するためにさらにHPLC精製が必要になります。また、各フラクションの採取量を減らすことで、純度の高いペプチドの回収率を向上させることができます。
各フラッシュクロマトグラフィーによるペプチド精製は、カラムの平衡化と洗浄を含めて約25分で完了し、粗ペプチド混合物の大部分は1時間未満で精製されたことは重要なポイントになります。
今回の結果から導き出される重要な結論がいくつかあります。
- グラジエント最適化のための標準的なHPLC精製は、フラッシュカラムクロマトグラフィーに容易に移植可能である。
- ペプチド精製のための逆相精製に、サンプル負荷のスケールアップのルールを適用することができる。
- 大量の粗ペプチドサンプルを迅速に精製することができ、粗ペプチドを完全に精製するのに要する時間を大幅に短縮することができる。
フラッシュカラムクロマトグラフィーを用いてペプチドを精製された方はいらっしゃいますか? また、溶出グラジエントを最適化する際に、どのようなテクニックが効果的でしたか?
ペプチドサンプルの精製にフラッシュクロマトグラフィーの使用を考慮したことがありますか?
高純度ペプチドを得るための様々な戦略についてご覧になりたい方は、リンクを参照してください。