September 27, 2019
Elizabeth Denton
逆相クロマトグラフィーによる精製は、サンプルの保持と溶出のためのグラジエントと、カラムの固定相に結合したオクタデシル鎖との相互作用によるところが大きいです。これは確かにペプチドの精製にも当てはまりますが、表面のアクセシビリティおよび粒子サイズもまた、分解能に重要な役割を果たします。粒子サイズは負荷量に影響しますが、ポアサイズは分子アクセシビリティ、したがって分解能に大きく影響します。
本日の投稿では、フラッシュカラムクロマトグラフィーを用いて、ポアサイズがあなたのペプチド精製にどのような影響を及ぼすかを紹介致します。
ポアサイズの影響は、HPLCに おいては粒径とポアサイズの両方組み合わせにより膨大な数のカラムが利用されていることからよく知られていますが、フラッシュカラムクロマトグラフィーでは一般的に議論されていません。最近、約 300Å のポアサイズを有する新しい C18 をもつメディアを評価することになり、ポアサイズによる影響を確認する機会を得ました。
ポアサイズの違いによる評価のため、Biotage SNAP Ultra C18(ポアサイズ100Å)*と、新しいカートリッジである Biotage SNAP Bio C18(ポアサイズ300Å)*2の分解能を比較しました。私は比較に使用するペプチドは、同じ条件で合成した粗ペプチドを評価することが極めて重要であると感じ、幸いにも私は最近、大きなスケールで ACP(65-74) を完了したところだったので、この ACP を使用することにしました。逆相での HPLC/MS 分析を行った後、ペプチドの純度は約36%と算出されました;このサンプルには多量の保護基の残渣を含んでいますが、今回の評価に最適な要素として Val の欠損ペプチドも含まれていました(図1)。
*現在、Biotage SNAP Ultra C18はBiotage® Sfär C18 Duo 100 Å 30 μmへ切り替わっております。リンク:https://www.biotage.com/product-page/biotage-sfr-c18-duo-100–30-m
*2現在、Biotage SNAP Bio C18はBiotage® Sfär Bio C18 Duo 300 Å 20 μmへ切り替わっております。同じメディアを使用しております。リンク:https://www.biotage.com/product-page/biotage-sfr-bio-c18-duo-300–20-m
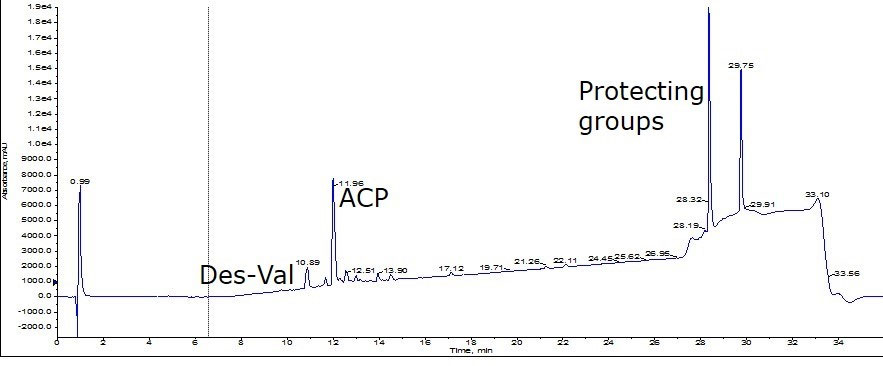
図 1: ACP65-74 ペプチドの分析用 HPLC クロマトグラム。
私はまず、Biotage SNAP Ultra C18 12g カートリッジで精製することにしました。ペプチド約 50 mg を DMSO に溶解し、カラムにチャージして精製を行いました(図2)。
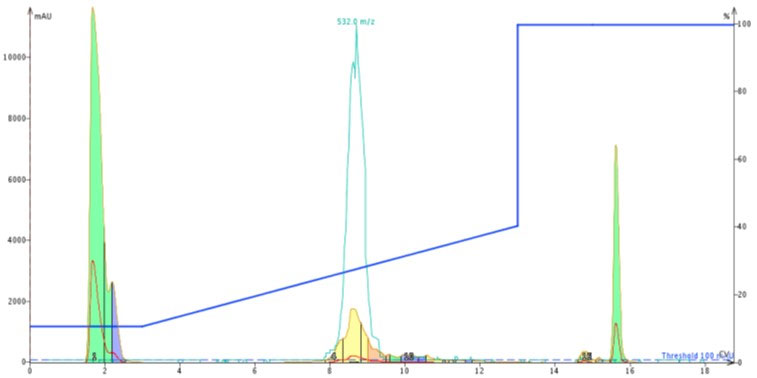
図 2: ACP 50mg を DMSO 300uL に溶解し、Biotage SNAP Ultra C18 12g カートリッジへチャージして精製した際に得られたクロマトグラム。精製条件としてアセトニトリルを 10% から 40% までのグラジエントで実施し、得られたペプチドは TFA 塩で得られました。
得られたフラッシュクロマトグラフィーのピークはきれいなで形状ではなく、不純物の存在を示唆しています。HPLC と同時に MS によるモニターも実施していましたが、ピークによるサンプルの採取は UV 吸光度に基づいて行いました。これらの方法を指針として黄色のピーク付近を分取し、Biotage V-10 濃縮装置 で濃縮し、分析用 HPLC/MS にてペプチドを分析したところ、純度は約 77%であることがわかりました(図3)。最も重大な点は、Val 欠損体は、この条件ではかならず観測されており、除去されませんでした。これはこのカートリッジの精製において最良の結果にはなりませんでした。
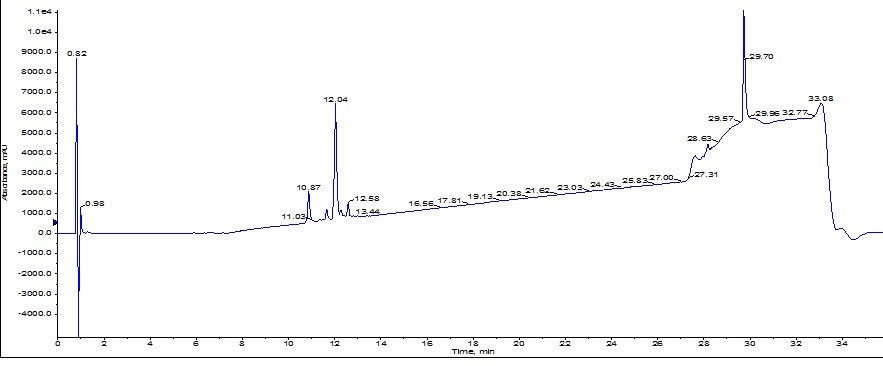
図 3: Biotage SNAP Ultra C18 カートリッジを用いて精製した ACP ペプチドの分析 HPLC。
比較のために、前回と同じグラジエン条件を用いて、ACPペプチド約 50 mgを DMSO に溶解し、Biotage SNAP Ultra C18 12g カートリッジにチャージして精製を行いました(図4)。
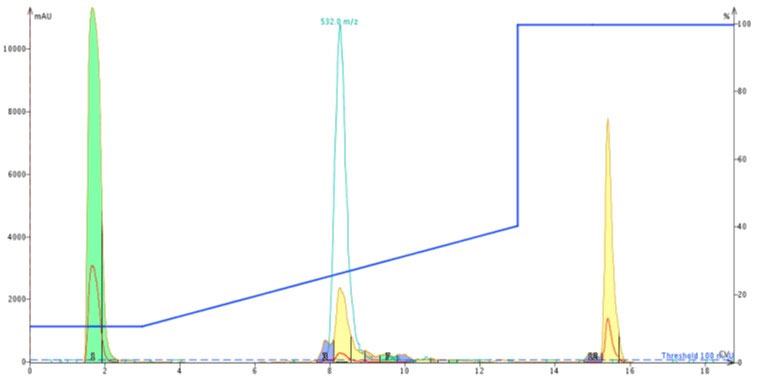
図 4: ACP 50mg を DMSO 溶解し、Biotage SNAP Bio C18 カートリッジへチャージして精製した際に得られたクロマトグラム。
ポアサイズが大きいメディアによるカートリッジの精製結果は、十分な分解能を発揮し、明確に不純物との分離を示しました。MS と UV によるモニターを指針とし、黄色のピーク付近を分取し、Biotage V-10 濃縮装置で迅速に濃縮し、分析用 HPLC/MS にてペプチドを分析しました。分析の結果、ペプチドの純度は約 92%となりました(図5)。SNAP Ultra C18 を大幅に改善する結果となりました。
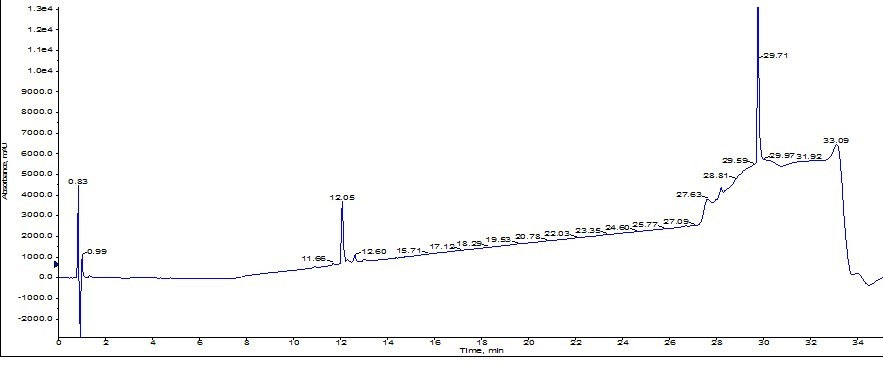
図 5: Biotage SNAP Bio C18 カートリッジを用いて精製した ACP の分析用 HPLC クロマトグラム。
追跡実験として、Biotage SNAP Ultra C18 を用いて精製されたペプチドを、新たに Biotage SNAP Bio C18 で再精製してみました。2回目になるフラッシュクロマトグラフィーでは、目的物のピークを明確に示しており、おそらく混入していた欠損ペプチドを分離することが示されました(図6)。
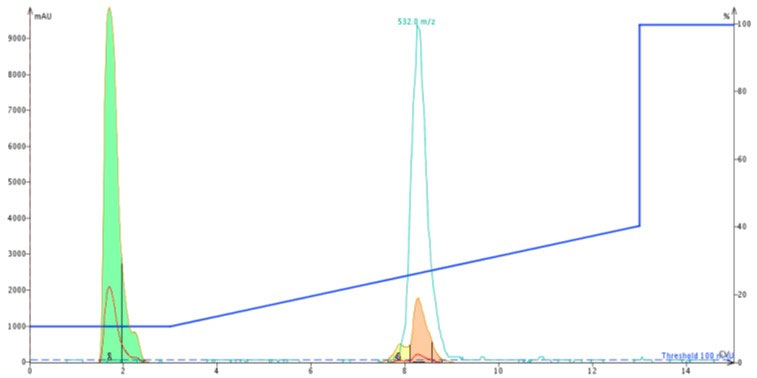
図 6: Biotage SNAP Bio C18 カートリッジを用いた ACP の2次精製したクロマトグラム。
得られたペプチドを分析 HPLC で解析したところ、2回目の精製作業により、純度は 77%から 93%まで改善されたことが明らかになりました(図7)。
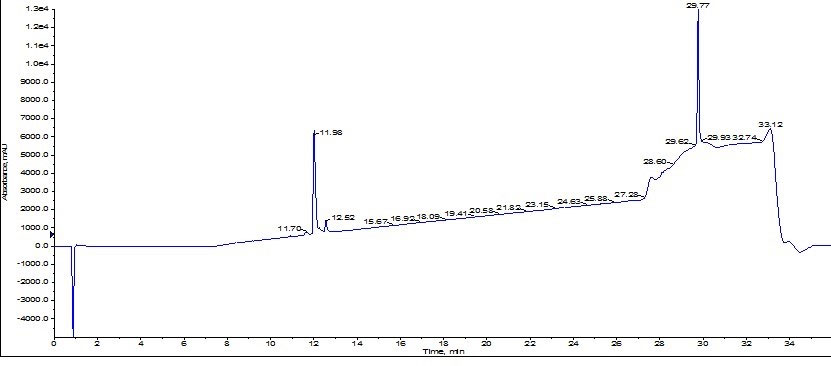
図 7: Biotage SNAP Ultra C18 カートリッジを用いて初めて精製された ACP のBiotage SNAP Bio C18 を用いた2回目の精製に起因する分析 HPLC クロマトグラム。
今回でのペプチド精製における純度の改善は、カラムへの負荷量の増減に関わるものではなく、ポアサイズによる影響が大きかったことが示唆されました。ポアサイズが大きいほど内部の固定相アルキル鎖への分子アクセシビリティが高くなり、その作用により目的の分子が固定相アルキル鎖と相互作用をもつ確率が高まります。フラッシュクロマトグラフィーでは、背圧が小さい状況で実施するため、大きなポアサイズが 1 回のチャージでより高純度のペプチド精製できることは明らかです。私は、より大きなペプチドについてもポアサイズが大きい SNAP Bio C18 が純度の高いペプチドが得られることを期待していますが、それはこれから議論していきたいと思います。
さまざまなポアサイズのカートリッジを用いてペプチドを精製した経験はありますか?
フラッシュクロマトグラフィーを用いてペプチドを高純度で得られる戦略について学ぶには、この リンク も参考にしてください。
日本語化:2020年9月
PDFファイルダウンロード(360MB)