Sep 27, 2019
Elizabeth Denton
ペプチドアプリケーションケミストとしての私の役割の中で、ペプチドの世界に初めて飛び込んでいる多くのグループと一緒に働く喜びを感じてきました。経験豊富な有機合成化学者にとってはかなり簡単なようですが、目的とする収率と純度を達成するには、固相ペプチド合成に固有の課題があることは確かです。
この投稿では、これまでのペプチド合成に携わった中で得られたヒントやコツをいくつか紹介したいと思います。
私が研究を始めた頃、固相ペプチド合成に慣れてきた中で私が遭遇した課題で発生したトラブルシューティングに対して研究室の大学院の先輩やポスドクは時間を割いてくれ、解決へ喜んでお手伝いしてくれました。ペプチド合成の過程は比較的簡単な有機反応が3~4回しかないにもかかわらず、粗収率と純度の両方の結果が不安定な結果が良く観察されました。これら結果の原因は、ほとんどが主に特異的なペプチド配列自体によるものです。私はこのリストに、合成の成功を確実化させる、最も信頼できるヒントや秘訣をいくつか載せてきいきます。
1. アミノ酸とカップリング試薬容液の濃度を上げます
これは理にかなっているはずです。結局、ペプチド鎖を延ばす際、1個のアミノ酸を付加するためには、2つの別々の濃度依存的な二分子反応が完了しなければなりません。試薬の濃度を上げることで、液量を減らし、アミノ酸やカップリング試薬の分子が適切に相互作用する可能性を高めることができます。アミノ酸濃度の影響は、特に長いペプチドの合成において明らかになっています。私はほんどのペプチド合成ではアミノ酸とカップリング試薬溶液の濃度を0.5Mに増やして実施しています。
2. プロリンの後に入ってくるアミノ酸をダブルカップリングさせます
私は、プロリンを含むペプチド中のアミノ酸の1回のカップリングで確実に成功していますが、プロリン残基の後のアミノ酸が導入されていないペプチドも合成されていました。最も可能性の高い原因は、反応性窒素が二級アミンであり、他のアミノ酸よりも特に求核的反応性が低いという事実です。これは、プロリンのアミンのpKaが、システインを除いて、他のすべてのアミノ酸よりも1単位低い(10.6対平均9.5)ことに注目することによって、最も容易に推測することができます。
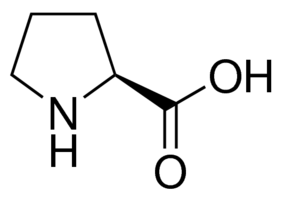
図 1:プロリンの化学構造。反応性窒素はピロリジンとして存在し、反応性を低下させている。
3. 同一アミノ酸が複数並んでいる場合にはダブルカップリング
大きな側鎖をもつ1個のアミノ酸しか含まないペプチドの中には、この場合多くの人がArginine 8を考えますが、最も単純な構造をもつAlanine 8を合成するのがどれだけ難しいのか驚くでしょう。同一アミノ酸が連続するペプチド配列の多くの場合、伸長しているペプチドにおいて溶解性の低下または二次構造形成が生じるためです。しかしながら、ある程度伸長した直鎖ペプチド配列中において、少数(2~4)の同一アミノ酸のみを含むペプチドを合成することも困難な場合があります。連続する同一アミノ酸に2番目または3番目へ連続してダブルにカップリングすることは、アミノ酸欠損ペプチドの存在を減少させ、全体的なペプチドの収率および純度を増加させるのに役立ちます。
4. アルギニン残基のダブルカップリング
アルギニンは、大きな側鎖およびそれに対応する保護基が主な理由で、あらゆるペプチド配列へ導入するのに困難さを伴います。これは、フェニルアラニン、トリプトファンまたはチロシンのような大きな側鎖を有するアミノ酸へアルギニンをカップリングする場合に特に顕著になります。アルギニンのペプチド鎖への完全な導入を確実にするための簡単な方法は、ダブルカップリングです。しかし、私は、ダブルカップリングにより反応時間を増加させましたが、アルギニンの導入を成功させました。
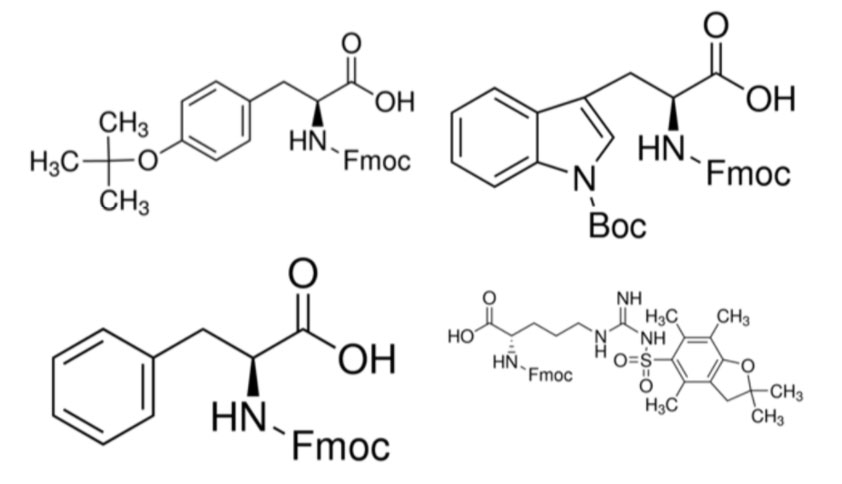
図 2: 側鎖のヒドロキシ基をtBu基で保護されたチロシン(左上)、側鎖のアミノ基をBoc基で保護されたトリプトファン(右上)、保護されたフェニルアラニン(左下)、保護されたアルギニン(右下)の化学構造、スペースがなく、構造が大きいためFmoc基の構造は省略しています。
5. アスパラギン酸残基を認識します
アスパラギン酸はペプチド合成の過程でアスパルチミドへの組み換えへの影響を受けやすいです。この副反応は塩基触媒作用を受け、アスパラギン酸残基がペプチド鎖へ導入された後、脱保護サイクルのたびにどの時点でも起こりえりますが、これは配列依存性があります。この転移によってβ-アミノ酸があるいはα-アミノ酸ペプチドへ組み換えられます(後述の反応機構参照)。残念ながら、この組み換えられた副生成物は質量と電荷が同じであり、本来の構造のペプチドをクロマトグラフィーで分離することはほとんど不可能です。合成中のこの副反応の可能性を制限または排除するために、いくつかの方法が発表されています。
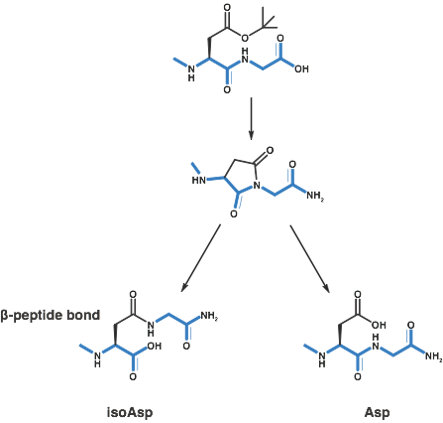
図3:固相ペプチド合成で観察される塩基触媒によるアスパルチミド転位のメカニズムiso-Asp副生成物は70%で有利に存在します。
特に難しいペプチド合成に成功するのに役立ったトリックは何ですか。
ペプチド合成のワークフロー効率を改善するためのBiotageツールについて詳しく知るには、下記のリンクをクリックしてください。
日本語化:2020年9月
PDFファイルダウンロード(320MB)