Molecular mechanism of interaction between SARS-CoV-2
and host cells and interventional therapy
Signal Transduction and Targeted Therapy (2021) 6:233
https://doi.org/10.1038/s41392-021-00653-w
Zhang et al.
ライフサイエンスに関連するトピックを毎月お届け致します。11回目となる今月は SARS-CoV-2 のスパイク・タンパク質が「どのように活性化するのか」を紹介致します。このようなサイエンティフィックな用語は、コロナ禍において「普段は馴染みのない」方々の日常生活にも溶け込んでまいりました。しかしながら、その詳細(構造、役割や分子メカニズム)については、おおくが語られていません。そこで、今月はスパイク・タンパク質を「もっと知りたい」という読者の『心』をくすぐるよう「もう一歩」踏みこんだ内容となっております。
SARS-CoV-2 の感染力は SARS-CoV にくらべ高いことが知られています。これは組織への嗜好性が「多岐にわたるから」と云われています。それゆえに ACE2(Angiotensin Converting Enzyme 2)をはじめとする受容体にかぎらず、その他の侵入経路(endosome経由)があることが示唆されています。
ホスト細胞と SARS-CoV-2 の「ファースト・コンタクト」で重要な役割をになうのが、今回のおはなしの主役であるスパイク・タンパク質であります。その「はたらき」とは、ウイルスの外膜とホスト細胞の膜(細胞膜やendosome)の融合を仲介することです。このタンパク質が活性化するまでには、2つまたは3つのproteaseが寄与することが知られています(図1)。興味深いことに、これらの protease はホスト細胞由来のものであり、SARS-CoV-2 をはじめとする他のウィルスでも同じような分子メカニズムがみられます。つまりは、わたしたち体内の酵素を「我が物顔」で利用し、さらには活性化までさせているのです。
さらに細かくみていきましょう。ここでは2つのホスト細胞由来の protease である *1 Furin と *2 TMPRSS2 に焦点をしぼり解説していきます。先月号にてお話ししたように、スパイク・タンパク質の RBD(Receptor Binding Domain)が ACE2 に結合することにより…、
① Furin により認識・開裂される。
② ①の処理を受けたのち TMPRSS2 により認識・開裂される。
*1 Furin;タイプ I の膜タンパク質。細胞内カルシウム依存的な serine-endopeptidase または前駆体タンパク質を活性化する proprotein convertase としても知られている。
*2 TMPRSS2;タイプ II の膜タンパク質。主には前立腺や気道上皮にて発現している。TMPRSS2-KO マウスには顕著なフェノタイプがないことから、その他のタイプII の膜 serine proteases による補完があると考えられている。
ゲノム解析の結果から SARS-CoV にはない4つのアミノ酸が SARS-CoV-2 のスパイク・タンパク質には挿入されていることがわかりました。これは PRRA(Proline-Arginine-Arginine-Alanine)といわれ Furin が認識・開裂する配列になり S1 / S2 の境界に位置(682-685)します(図1)。この構造変化により TMPRSS2 の認識・開裂部位が露出しアクセスしやすくなります。このモチーフを欠失させると SARS-CoV-2 とホストの細胞間融合能が顕著に低下することが明らかになりました。in vitroの結果にはなりますが、このモチーフは、ウィルス増殖能には影響しないことがわかっています。つまりは、このFurinによる認識・切断が SARS-CoV-2 のスパイク・タンパク質を効率良く修飾することで、SARS-CoV よりも感染力が高まっていると考えられています。
TMPRSS2 は Furin とは異なり SARS-CoV においてもスパイク・タンパク質を認識・開裂します。その部位は S2 domain にあり Furin とは異なるモチーフになります(図1)。興味深いことに TMPRSS2 はスパイク・タンパク質が受容体に結合したのちに ACE2 も切断してしまいます。これにより S1 と S2 の構造変化が起こりスパイク・タンパク質内の fusion peptide が露出し SARS-CoV-2 とホストの細胞間融合のプロセスに入ります。
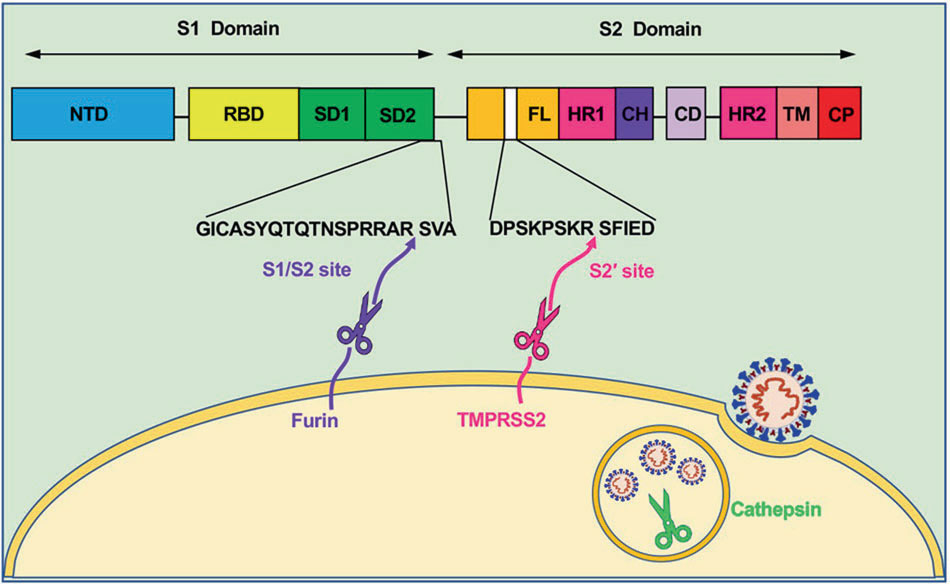
図1: Molecular mechanism of interaction between SARS-CoV-2
and host cells and interventional therapy
Signal Transduction and Targeted Therapy (2021) 6:233
https://doi.org/10.1038/s41392-021-00653-w
Zhang et al.
図3より抜粋
図1の解説;SARS-CoV-2の膜融合と侵入には3つのproteaseが関与している
① 前駆体タンパク質を活性化する Furin
② Transmembrane serine protease の TMPRSS2
③ Lysosomal protease の Cathepsins
SARS-CoV-2 のスパイク・タンパク質のドメイン構造は、左から順に NTD; N terminal domain, RBD; Receptor Binding Domain, SD1; SubDomain 1, SD2; SubDomain 2, FL; Fusion Loop, HR1; Heptad Repeat 1, CH; Central Helix, CD; Connector Domain, HR2; Heptad Repeat 2, TM; TransMembrane region & CP; CytoPlasmic tail domain となる。
Furin の認識・開裂部位は S1/S2 domain の境界に位置する。TMPRSS2 の認識・開裂部位(S2’)は FL 内に位置する。1回目のプロセッシングを Furin から受けることで S2’ が露出する。2回目のプロセッシングをTMPRSS2 から受けることで FL 内の fusion peptide が露出し、ホストの細胞膜にアンカーすることで細胞融合が促進される。
2回のプロセッシングを適切に受けたスパイク・タンパク質内の S2 domain では近接する HR1(Heptad Repeat 1)と HR2(Heptad Repeat 2)の相互作用がうながされ 6-HB(6-Helix Bundle)fusion core をつくることが可能となります。先月号でお話ししたように、スパイク・タンパク質は「3量体」を形成しますので 6-HB となります。これにより SARS-CoV-2 とホスト細胞間の膜融合が完了します(図2)。SARS-CoV-2 が侵入に成功すれば uncoated の状態となり、ウィルス RNA ゲノムが細胞質にどんどん投下されていきます。
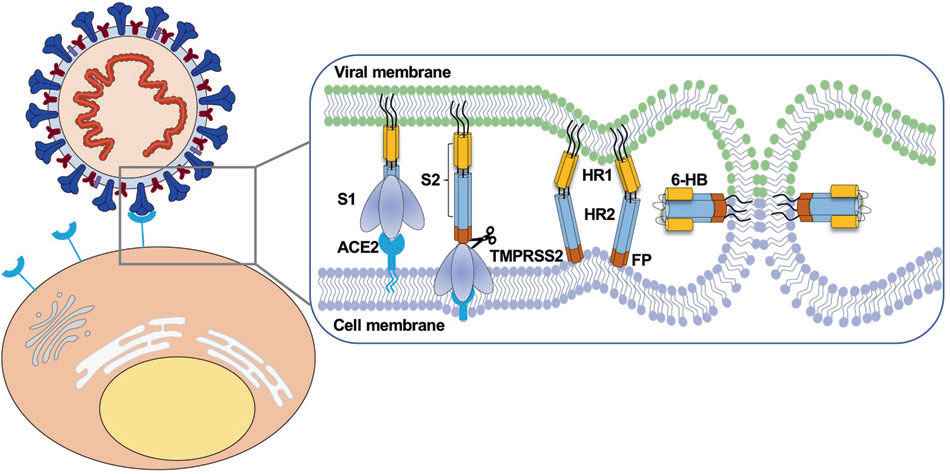
図2: Molecular mechanism of interaction between SARS-CoV-2
and host cells and interventional therapy
Signal Transduction and Targeted Therapy (2021) 6:233
https://doi.org/10.1038/s41392-021-00653-w
Zhang et al.
図4より抜粋
図2の解説;SARS-CoV-2のホスト細胞への侵入過程
スパイク・タンパク質が ACE2 に結合すると TMPRSS2 により認識・開裂され S1 と S2 subunit に分かれる。つづいて S2 subunit の HR1 と HR2 がゆっくりとウィルスとホストを引っ張りながら近寄り、最終的に相互作用することで 6-HB をつくりあげる。これにより SARS-CoV-2 のエンベロープとホストの細胞膜の融合が完了する。
前述したように SARS-CoV-2 に代表されるウィルスには複数の侵入経路が存在します。それは endosome 経由です。この侵入の最終ステップ(ホスト細胞内)においても、おなじようにスパイク・タンパク質の認識・開裂が必要となるのです。つまりは SARS-CoV-2 も endosome での Cathepsins によるスパイク・タンパク質の認識・開裂が必須になります。
Cathepsins は lysosomal proteases の一種であり、細胞内のタンパク質のリサイクリングにおいて重要な役割をにないます。ここでは Cathepsins B と L に焦点を絞りお話しします。実際に Cathepsins B と L をそれぞれ阻害する実験をしてみたところ、L のみが SARS-CoV-2、SARS-CoV や MERS-CoV の侵入を顕著に低減させることがわかりました。Cathepsins L は lysosomal protease なので、この実験結果は SARS-CoV とおなじように SARS-CoV-2 も endocytosis をつうじ、ホスト細胞へと侵入を図っていることを示唆しています。
しかしながら、この実験系は利用する細胞腫に大きく依存します。なぜならば前述したように SARS-CoV-2 は組織への嗜好性が多岐にわたるからであり、その組織の細胞で発現しているさまざまな proteases に影響をおおきく受けます。たとえば TMPRSS2 の発現は高いが、Cathepsins の活性が低い human lung cell line を利用した場合はで S2 ’の開裂を阻害することで SARS-CoV-2 の侵入を低減することが可能です。一方で TMPRSS2 がないけれども Cathepsins の活性が高い monkey kidney epithelial cell line を利用した場合では S2’ の開裂を阻害しても SARS-CoV-2 の侵入を低減することはできませんでした。
このように組織により活性化している protease やスパイク・タンパク質の活性化メカニズムが異なることからもウィルスが巧みな「サバイバル技術」を利用し、わたしたち体内への侵入を図っている様子がうかがえます。ウイルスと受容体の相互作用や protease の関与など侵入の詳細な分子メカニズムの解析がすすむと「どのステップ」をブロックすれば、効率良く SARS-CoV-2 や未知のウィルスの「感染や増殖を抑えることができるのか」という情報につながってくるでしょう。今後のさらなる研究に期待がかかります。
SARS-CoV-2 の感染メカニズムを紐解き、治療薬開発へと結びつけるため、世界中の研究員たちは莫大な数の…、
① プラスミド DNA の精製
② 抗体の精製
③ in vitro/in vivo での評価
上記の3つを継続的に「ひとつひとつ」入念におこなう必要があります。
これらを「ひとつずつ」マニュアルで検証していくと莫大な労力、時間や資金を要します。それゆえに「同じ条件」で「再現性高く」これらのステップをおこなうには、ロボットによるオートメーションが求められてくるでしょう。
このような要求に応えられるよう、わたしたち Biotage®はオートメーションに適した製品を数おおく提供しています。
① PhyTip®カラムはタンパク質、抗体やウィルスの精製に適した製品であり、さまざまなアプリケーションに対応しているので、主要なリキッド・ハンドラーに搭載することができます。
② PhyPrep®は自動でマキシ〜ギガ・スケールのプラスミド DNA を精製するロボットです。得られる産物はエンドトキシン・フリーですので、そのまま transfection に利用できます。
Biotage®は「Labオートメーション」を推しすすめ、研究者をルーティンから解放することで「貴重な時間」を提供しています。
参考文献
- Molecular mechanism of interaction between SARS-CoV-2
and host cells and interventional therapy
Signal Transduction and Targeted Therapy (2021) 6:233
https://doi.org/10.1038/s41392-021-00653-w
Zhang et al.