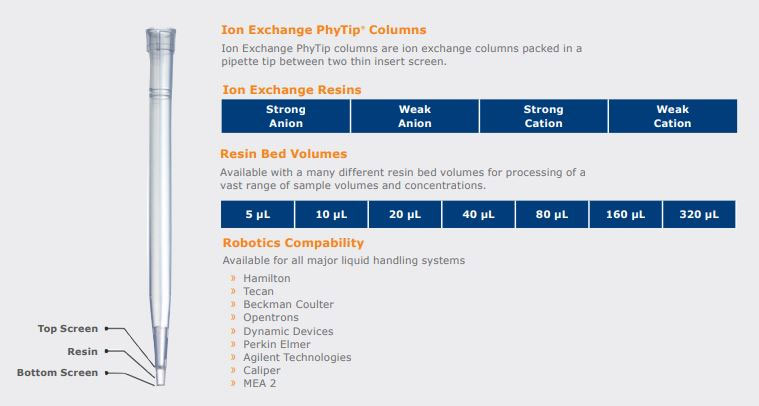
Ion Exchange PhyTip® Columns
イオン交換ピペット・チップ型 PhyTip® カラム

イオン交換クロマトグラフィーは、可溶性のタンパク質の多くに適応できうる精製方法です。このクロマトグラフィーに搭載するレジン(担体)には、正に荷電した陰イオン交換体と負に荷電した陽イオン交換体があります。ターゲットのタンパク質と逆の電荷をもつレジンとを可逆的に結合・溶出させて精製します。
中性の水溶液中におけるタンパク質は、アミノ基が -NH3+ にカルボキシル基が -COO– に解離した状態です。このような正と負の電荷をもつタンパク質の総電荷は pH に依存します。総電荷が 0 になる pH を等電点(pI)といいます。タンパク質の構成要素であるアミノ酸の荷電状態は pH によって変わりますで、タンパク質の総電荷も溶液の pH に依存して正や負へ変化します。タンパク質がもつ総電荷は pI より高い pH の水溶液中では負となりますが、pI より低い pH の水溶液中では正となります(図1)。
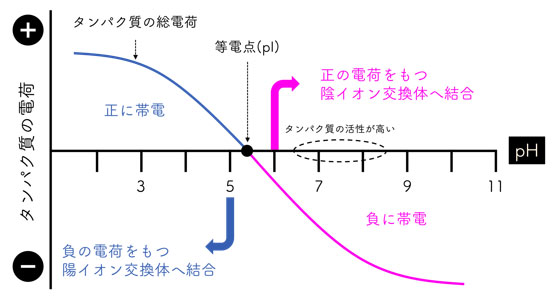
図1. pH によるタンパク質の総電荷の変化。
このタンパク質は pI が pH5.5 付近にあり、活性があるのは pH6.5~8.5 の間と仮定します。このタンパク質を「活性を保ったまま」精製するには、陰イオン交換体を選択します。
負の総電荷をもつタンパク質は正の電荷をもつ陰イオン交換体に、正の総電荷をもつタンパク質は負の電荷をもつ陽イオン交換体に結合することができます。この結合能力は、タンパク質の総電荷に依存しています。
イオン交換体に結合したタンパク質の溶出には、溶出バッファーのイオン強度(塩濃度)を増やす方法が一般的に用いられます。対イオンをタンパク質の代わりにイオン交換体に拮抗・結合させることで、結合の弱いタンパク質を徐々に遊離させて溶出していきます(図2)。つまり、タンパク質のもつ総電荷と解離基とのイオン結合の状態をpHでコントロールすることで、結合と溶出のバランスを操作します。
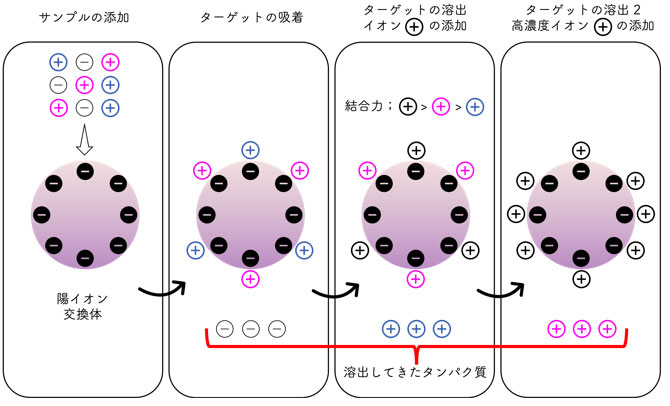
図2. 陽イオン交換クロマトグラフィーの原理。
バッファー中で+の電荷をもつ分子(+と+)はレジンへ結合するが、ーの電荷をもつ分子(ー)は結合できない。バッファー中の塩濃度をあげると、電荷の数が少なく結合力の弱い分子(+)がまず溶出される。つづいて電荷の数が多く結合力の強い分子(+)が溶出される。
正しいカラムの選択
陰イオン交換体と陽イオン交換体のどちらを精製に用いるかは、以下に記す3つの要素を検討します。タンパク質の ① 総電荷、② 活性 や ③ 安定性を考慮し、どちらが最適かを決定します(図1)。前述しましたように、タンパク質の総電荷は、バッファーの pH によって変化します。それゆえに、pI と総電荷の関係は以下のようになります…、
– バッファーの pH が pI より低い:正に帯電 → 陽イオン交換体へ結合。
– バッファーの pH が pI より高い:負に帯電 → 陰イオン交換体へ結合。
活性については精製する前に予備実験をおこない、確認する必要があります。
検討を要する代表的なものとして、① pH、② 塩濃度、③ 温度 や ④ 高次構造があげられます。
イオン交換体にはそれぞれ強弱があります。これはタンパク質との結合に起因するのではなく、pHの変動により、イオンとの結合状態の変化への対応が「強い」のか、または影響をうけやすく「弱い」のかを表します。
バッファーのpHとイオン強度の最適化
精製に利用するバッファーの性質については、次の 3点が重要になります…、
- タンパク質の安定性や活性に影響を及ぼさないこと。
- ターゲットであるタンパク質がレジンにきちんと結合すること。
- 結合したタンパク質を効率良く溶出できること。
バッファーの pH がターゲットのタンパク質の生理的条件からかけ離れていると、沈殿が生じたり、活性を失うことがあります。特にターゲットの生理活性を知りたい場合は、精製条件の pH とイオン強度における安定性を予備実験にて詳細に調べておくことが重要です。
ターゲットのタンパク質の pI を把握しているケースでは、使用するバッファーの条件をあらかじめ絞るができます。イオン強度が 100 mM のとき、pH を pI から 0.5 以内に近づけると、タンパク質は結合したレジンから溶出しはじめます。それゆえに、ターゲットがレジンにしっかりと結合するような以下に記す平衡化や懸濁バッファーの条件を考慮することが大切です。
– 陰イオン交換体: バッファーの pH をターゲットの pI より 0.5~1 以上高くする。
– 陽イオン交換体: バッファーの pH をターゲットの pI より 0.5~1 以上低くする。
わたしたち Biotage は、独自の技術 Dual Flow Chromatography を備えたピペット・チップ型の PhyTip®カラムに強/弱の陰/陽イオン交換体を搭載しました。これにより「吸引・吐出」のサイクル数や flow rate を自由自在にコントロールすることで、目的タンパク質の精製に適した条件を探ることが容易になります。PhyTip カラム イオン交換体を利用することで、以下に記す3つのことを容易に実現できるようになります。
① Capture → Wash → Elution の各種ステップの条件検討(最適化の模索)
② 機能的なタンパク質であるかを評価するための少量精製
③ 各社リキッド・ハンドラーに装着することで、タンパク質精製の high-throughput を自動化
AAV や抗体精製と組みあわせることで work-flow の最適化を図れます。少量で多くのサンプルを取りあつかう研究員たちの頼もしい味方となるでしょう。
陽イオン交換体を搭載した PhyTip®カラムは効率良くターゲットを捉えます
[ 実験の条件 ]
- 陽イオン交換体を搭載した PhyTip カラム(ターゲット;Lysozyme)
- Lysozyme を懸濁したバッファー;25 mM Na-citrate(pH6.0) & 5mM NaCl
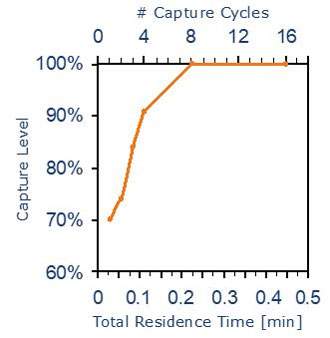
[ 実験結果の解説(図3参照)]
このグラフは、陽イオン交換体を搭載したPhyTip で Lysozyme を精製した実験になります。
「吸引 → 停止 → 吐出 → 停止」のサイクルを繰りかえし 4 回おこなうと 90% 以上の Lysozyme を捉えることができます。さらに 8 回目のサイクルで飽和状態に達し、効率良くターゲットを捉えることに成功しています。
陰/陽イオン交換体を搭載したPhyTip®カラムは効率良くターゲットを溶出します
[ 実験の条件 ]
- 弱陰イオン交換体を搭載した PhyTip カラム(ターゲット;BSA)
- BSAを懸濁したバッファー;25 mM Tris(pH8.0) & 5 mM NaCl
- 弱陽イオン交換体を搭載した PhyTip カラム(ターゲット;Lysozyme)
- Lysozyme を懸濁したバッファー;25 mM Na-citrate(pH6.0) & 5mM NaCl
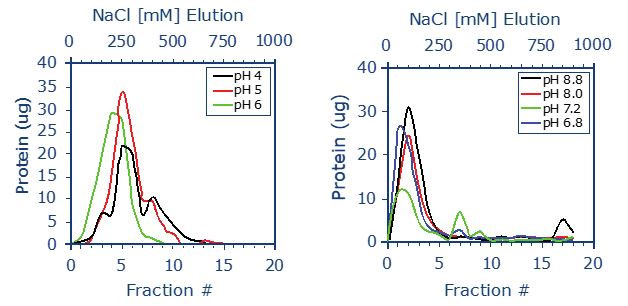
[ 実験結果の解説(図4参照)]
左は弱陰イオン交換体を搭載した PhyTip で BSA を、右は弱陽イオン交換体を搭載した PhyTip で Lysozyme を精製したそれぞれの実験結果になります。
(左図)BSA の pI は、およそ 5 なので、弱陰イオン交換体から効率良く溶出するには pH を pI 付近の 5.0 に調節します。赤のラインが示すように pH5.0、NaCl 250 mM のバッファーで BSA がレジンから溶出されています。
(右図)Lysozyme の pI は、およそ 11 なので、弱陽イオン交換体から効率良く溶出するには pH を pI に近づくよう調節します。黒のラインが示すように pH8.8、NaCl 100 mM のバッファーで Lysozyme がレジンから溶出されています。
注文情報
200 µL format
PTR-92-05-11 PhyTip® 200 µl format, 5 µl Strong Anion (96/pk), MEA
PTR-92-20-11 PhyTip® 200 µL format, 20 µL Strong Anion (96/pk), MEA
PTR-92-05-12 PhyTip® 200 µl format, 5 µl Weak Anion (96/pk), MEA
PTR-92-20-12 PhyTip® 200 µl format, 20 µl Weak Anion (96/pk), MEA
PTR-92-05-13 PhyTip® 200 µl format, 5 µl Strong Cation (96/pk), MEA
PTR-92-20-13 PhyTip® 200 µl format, 20 µl Strong Cation (96/pk), MEA
PTR-92-05-14 PhyTip® 200 µl format, 5 µl Weak Cation (96/pk), MEA
PTR-92-20-14 PhyTip® 200 µl format, 20 µl Weak Cation (96/pk), MEA
1,000 µL format
PTR-91-10-11 PhyTip® 1 ml format, 10 µl Strong Anion (96/pk), MEA
PTR-91-20-11 PhyTip® 1 mL format, 20 µL Strong Anion (96/pk), MEA
PTR-91-40-11 PhyTip® 1 mL format, 40 µL Strong Anion (96/pk), MEA
PTR-91-80-11 PhyTip® 1 mL format, 80 µL Strong Anion (96/pk), MEA
PTR-91-16-11 PhyTip® 1 mL format, 160 µL Strong Anion (96/pk), MEA
PTR-91-10-12 PhyTip® 1 ml format, 10 µl Weak Anion (96/pk), MEA
PTR-91-20-12 PhyTip® 1 mL format, 20 µL Weak Anion (96/pk), MEA
PTR-91-40-12 PhyTip® 1 mL format, 40 µL Weak Anion (96/pk), MEA
PTR-91-80-12 PhyTip® 1 mL format, 80 µL Weak Anion (96/pk), MEA
PTR-91-16-12 PhyTip® 1 mL format, 160 µL Weak Anion (96/pk), MEA
PTR-91-10-13 PhyTip® 1 ml format, 10 µl Strong Cation (96/pk), MEA
PTR-91-20-13 PhyTip® 1 mL format, 20 µL Strong Cation (96/pk), MEA
PTR-91-40-13 PhyTip® 1 mL format, 40 µL Strong Cation (96/pk), MEA
PTR-91-80-13 PhyTip® 1 mL format, 80 µL Strong Cation (96/pk), MEA
PTR-91-16-13 PhyTip® 1 mL format, 160 µL Strong Cation (96/pk), MEA
PTR-91-10-14 PhyTip® 1 ml format, 10 µl Weak Cation (96/pk), MEA
PTR-91-20-14 PhyTip® 1 mL format, 20 µL Weak Cation (96/pk), MEA
PTR-91-40-14 PhyTip® 1 mL format, 40 µL Weak Cation (96/pk), MEA
PTR-91-80-14 PhyTip® 1 mL format, 80 µL Weak Cation (96/pk), MEA
PTR-91-16-14 PhyTip® 1 mL format, 160 µL Weak Cation (96/pk), MEA

